《细胞·代谢》:抗体竟是肥胖帮凶!北大团队发现,IgG是胰岛素受体的天然抑制因子,脂肪组织积累IgG会导致胰岛素抵抗和慢性炎症
来源:代丝雨 2025-01-03 12:18
研究者通过实验和AlphaFold2的帮助,发现IgG的Fc段中CH3结构域竟然能够与胰岛素受体的IgLD1结构域结合。
到底是什么让脂肪组织“生病”?答案可能让你意想不到——是我们体内含量最高的免疫球蛋白,IgG,也就是我们通俗认知里的抗体。
近期,北京大学强力、汪丽恒团队在《细胞·代谢》杂志发表论文,研究者们发现,肥胖中,IgG会大量积累在白色脂肪组织内,而且IgG竟然能够直接与胰岛素受体(IR)结合,抢占胰岛素的工作空间,造成胰岛素抵抗,并由此引发后续的一系列代谢问题。
好在,研究者们发现,只要能够干扰IgG的积累,就很有希望让脂肪组织恢复健康、逆转代谢障碍。
论文题图
此前有研究发现,在饮食诱导的肥胖(DIO)中,B细胞会大量浸润脂肪组织。B细胞是生产IgG的主要细胞,研究者们关注IgG也不足为奇。
分析结果显示,喂食高脂饮食(HFD)让小鼠变胖后,小鼠的附睾白色脂肪(eWAT)中累积了大量的IgG,足有对照小鼠的16倍之多。相较之下,小鼠循环中的IgG水平仅增加了1倍,白色脂肪组织外的其他组织也没有观察到IgG的积累。
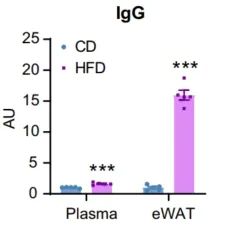
白色脂肪组织中IgG大量积累
更过分的是,当研究将从胖小鼠分离出的IgG注射给瘦小鼠,每周两次、持续4周,瘦小鼠的白色脂肪中竟然也积累起了IgG,并且已经对小鼠的胰岛素敏感性造成了损伤。
是什么让IgG如此大量累积?此前已有研究发现,积累IgG,靠B细胞多生多产,不如靠IgG循环利用,这一过程依赖的就是新生儿Fc受体(FcRn)。
脂肪组织中,脂肪祖细胞(APC)和巨噬细胞都能表达FcRn。研究者发现,在饮食诱导的肥胖早期,APC表达的FcRn就已经将IgG套牢,IgG积累会吸引巨噬细胞浸润脂肪组织和慢性炎症,与之伴随的IgG的积累还会进一步增加。
这下恶性循环了。
在实验中,研究者们注意到,给瘦小鼠注射IgG后,小鼠的胰岛素敏感性损伤得可以说是非常之快,一夜的功夫就足以导致明显的变化,看来IgG积累多了“毒性”真不是一般的大。
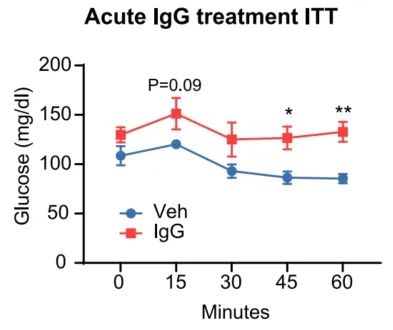
瘦小鼠注射IgG后胰岛素敏感性显著受损
研究者通过实验和AlphaFold2的帮助,发现IgG的Fc段中CH3结构域竟然能够与胰岛素受体的IgLD1结构域结合。
后续实验结果更是发现,胰岛素与胰岛素受体之间的常态解离常数14.76nM,在加入0.52μM IgG共孵育10分钟后,就飙升至30.76nM了。而0.52μM其实还远低于IgG的生理水平(20-67μM≈3-10mg/ml)。
简单来说,IgG其实会和胰岛素竞争与胰岛素受体结合的机会,让胰岛素更难发挥作用,胰岛素抵抗就这样轻易地发生了。
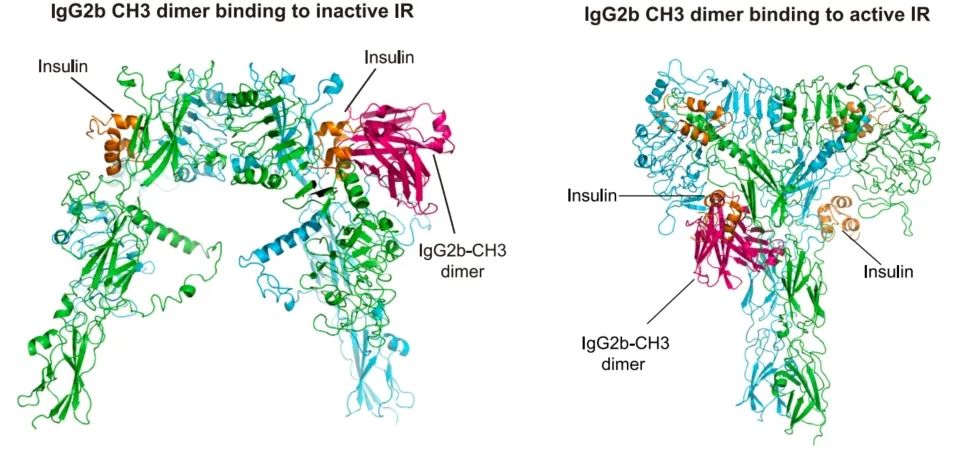
IgG与胰岛素竞争结合胰岛素受体
了解了这一机制,研究者猜测,FcRn可能是肥胖的潜在治疗靶点。
研究者设计了靶向编码FcRn的Fcgrt基因的反义寡核苷酸(ASO),抑制其介导的IgG积累。实验结果显示,ASO显著降低了血浆IgG水平,虽然小鼠的体重和脂肪组成没有变化,但葡萄糖耐量和胰岛素敏感性显著改善了。
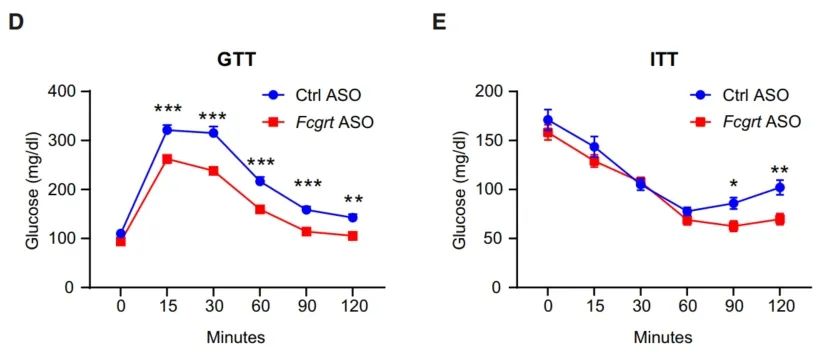
ASO显著改善胰岛素敏感性和糖耐量
治疗7周后,可以观察到血浆胰岛素水平降低,白色脂肪组织中脂肪生成基因和棕色脂肪细胞标记物水平增加,说明脂肪组织代谢重塑。
还好还好,还有机会拦截IgG。
不过我还是挺惊讶的,IgG竟然是胰岛素受体的一种天然抑制因子,不知道还有没有其他这样跨次元的神秘联动呢。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


