Nature:人类“结构域组”或有望揭示遗传性疾病发生的根本原因
来源:生物谷原创 2025-01-16 11:05
本文研究揭示了大规模分析人类蛋白质突变体的可行性,并为临床突变解释、训练和计算方法的基准测试提供了一个大型一致的参考数据集。
改变蛋白质氨基酸序列的错义突变(missense variants)会引起三分之一的人类遗传性疾病发生,而数以千万计的错义突变存在于当前的人群中,其中绝大多数具有未知的功能性后果。近日,一篇发表在国际杂志Nature上题为“Site-saturation mutagenesis of 500 human protein domains”的研究报告中,来自巴塞罗那科技学院等机构的科学家们通过对人类蛋白质变异进行大规模研究后发现,大多数通过将一种氨基酸替换为另一种氨基酸而引起疾病的突变,或许都是通过使蛋白质不那么稳定来实现的;而不稳定蛋白质更容易发生错误折叠和降解,这就会导致其停止工作或在细胞内积累有害的数量。
这项研究或能帮助解释为何人类基因组中的微小改变(错误突变,missense mutations)会在分子水平上引起疾病发生,他们发现,蛋白质不稳定就是遗传性白内障形成的主要驱动因素,同时也会导致不同类型的神经、发育和肌肉萎缩性疾病发生。文章中,研究人员对众所周知的621种已知的致病性错义突变进行了研究,其中有五分之三(61%)的突变会导致能检测到蛋白质稳定性的下降。
于是研究人员更加密切地关注一些致病性的突变,比如β-γ晶体蛋白就是维持人眼晶状体清晰度所必需的一种蛋白家族,他们发现,72%(18个中有13个)的与白内障形成相关的突变都会破坏晶体蛋白的稳定性,从而使得蛋白更容易积累聚集并在晶状体中形成不透明的区域。研究人员还将蛋白质的不稳定性与还原体肌病(reducing body myopathy)联系一起来,还原体肌病是一种罕见的疾病,其能引起肌肉无力和消瘦以及睑缘粘连-外胚层缺陷及唇腭裂综合症(AEC综合征,ankyloblepharon-ectodermal defects-clefting syndrome),其是一种以腭裂和其它发育症状为特征的疾病。
然而,一些致病性突变并不会破坏蛋白质的稳定性,于是研究人员发现其它分子机制或许发挥着一定的作用。Rett综合征是一种能引起严重认知和机体损伤的神经系统疾病,其是因MECP2基因突变所致,MECP2基因能产生一种负责调节大脑中基因表达的特殊蛋白。研究人员发现,MECP2的很多突变并不会破坏蛋白质的稳定性,而是在影响MECP2与DNA的结合从而调节其它基因表达的区域中被发现,这种功能丧失或许会扰乱大脑的发育和功能。研究者Antoni Beltran表示,如今我们以前所未有的规模在分子水平上揭示了突变是如何引起疾病发生的。通过区分突变是否会让蛋白质不稳定还是在不影响其稳定性的情况下改变其功能,我们就能制定出更为精准的治疗性策略,这或许意味着开发能稳定蛋白质的药物和开发抑制有害活性的药物之间的区别,而这也是科学家们向个体化医学研究领域迈出的重要一步。
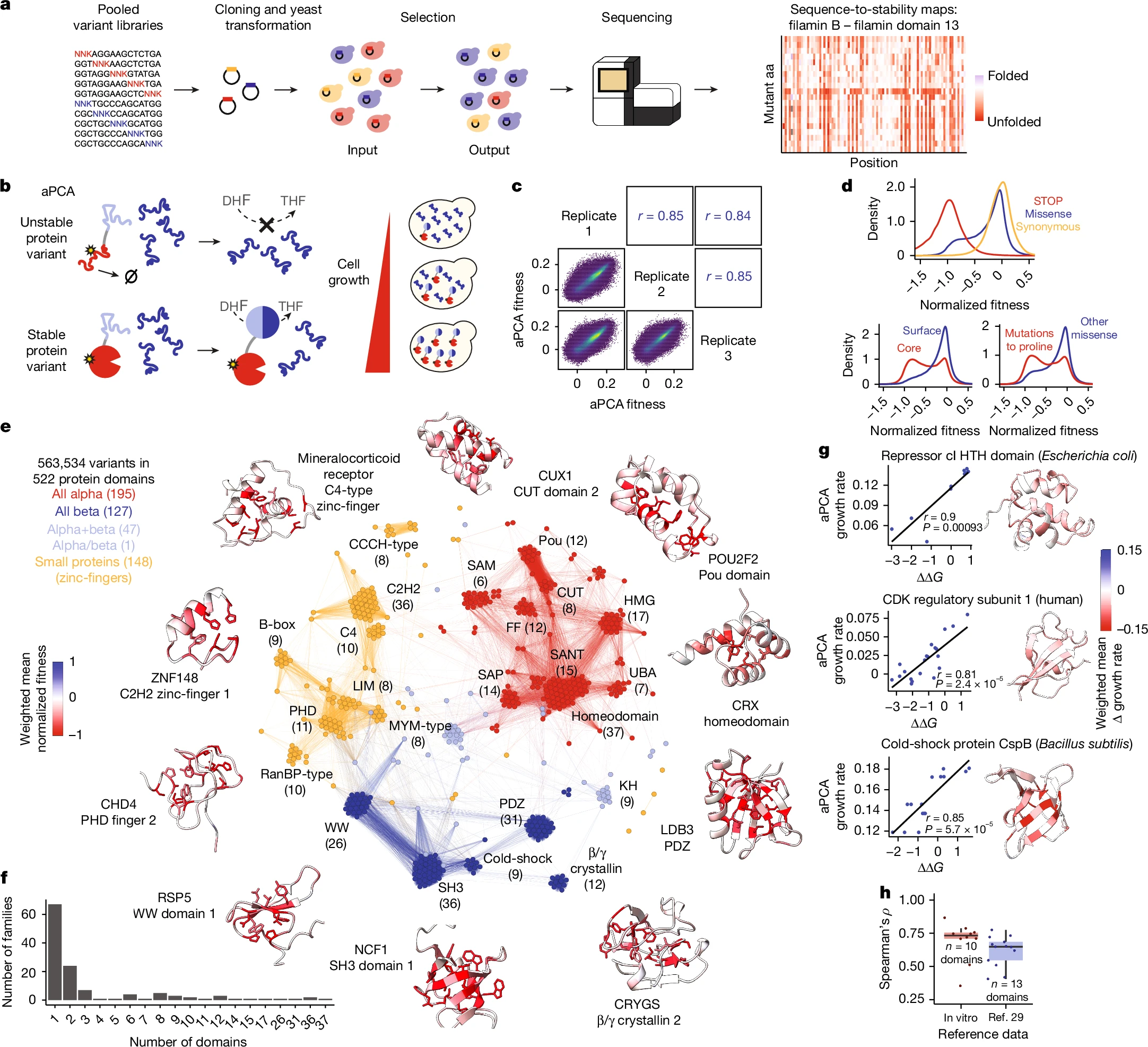
人类蛋白质结构域组的突变
本文研究还发现,突变引起疾病的方式通常与疾病是隐性或显性有关,当显性遗传病发生时,一个突变基因的单一拷贝就足以引起疾病发生,即使另一个拷贝是正常的;而当隐性疾病发生时,个体或许就会从父母那里遗传两个突变基因的拷贝。引起隐性疾病的突变更有可能促使蛋白质不稳定,而引起显性疾病的突变通常会影响蛋白质功能的其它方面,比如与DNA或其它蛋白质的相互作用,而不仅仅是其稳定性。比如,本文研究发现,对眼睛功能非常重要的CRX蛋白的隐性突变会显著破坏蛋白质的稳定性,这或许就会引起遗传性视网膜营养不良,因为缺乏稳定功能性的蛋白质就会损伤正常的视力。
然而,两种不同类型的显性突变意味着蛋白质能保持稳定,但功能却不正常,从而就会引起视网膜疾病发生,即使蛋白质的结构是完整的。这些研究发现之所以成为可能或许要归功于人类结构域组1(Human Domainome 1)的创建,其是一个巨大的蛋白质突变体文库,该文库中包括了522个人类蛋白质结构域的50多万个突变,这些蛋白质结构域能决定其功能,而且这也是迄今为止最大的人类蛋白质结构域突变体目录。蛋白质结构域是一种特殊的区域,其能折叠成为一种稳定的结构并独立于蛋白质的其余部分来发挥作用,人类结构域组1则是通过系统性地将这些结构域中每个氨基酸改变为其它所有可能的氨基酸而创建的,从而就创建了所有可能性突变的目录。
这些突变对蛋白质稳定性的影响是通过将突变蛋白质结构域引入到酵母细胞中发现的,转化后的酵母只能产生一种类型突变的蛋白质结构域,而其培养物能在试管中生长,条件就是将蛋白质的稳定性与酵母的生长联系起来;如果突变蛋白是稳定的,酵母细胞就会生长地很好,但如果蛋白质不稳定,那么酵母细胞的生长就会较差。利用一种特殊技术,研究人员就能确保只有产生稳定蛋白质的酵母细胞能得以存活和繁殖,通过比较酵母生长前后每个突变的频率,研究人员就能确定哪些突变会导致蛋白质变得稳定,哪些会导致其变得不稳定。尽管人类结构域组1要比此前的蛋白质突变体文库大4.5倍,但其仍然仅覆盖了2.5%的已知人类蛋白质,随着研究人员不断增加目录的规模,致病突变对蛋白质不稳定性的确切贡献将会变得越来越清楚。
与此同时,研究人员还利用522个蛋白质结构域的信息来推断出相似的蛋白质,这是因为突变通常会对结构或功能相关的蛋白质产生类似的影响,通过分析一组不同的蛋白质结构域,研究人员发现了突变影响蛋白质稳定性的模式,而这些模式在相关蛋白质中或许是一致的。研究者Ben Lehner说道,从本质上来讲,这意味着来自一个蛋白质结构域的数据能帮助预测突变如何影响相同家族或具有相似结构的其它蛋白质,来自这些522个结构域的“规则”就足以帮助研究人员对目录中更多的蛋白质做出有根据的预测。这项研究还存在一定的局限性,研究人员对蛋白质结构域进行了分离分析而不是对全长蛋白质进行分析,在生物体中,蛋白质能与蛋白质其它部位以及细胞中的其它分子相互作用。
这项研究或许无法完全捕捉到突变如何影响人类细胞中自然栖息的蛋白质,于是他们计划通过研究更长的蛋白质结构域的突变来克服这一问题,并最终研究全长的蛋白质;最终,研究人员希望能绘制出每种可能的突变对每一个人类蛋白质所产生的影响,而这一努力或有望改变精准医学的研究领域。综上,本文研究揭示了大规模分析人类蛋白质突变体的可行性,并为临床突变解释、训练和计算方法的基准测试提供了一个大型一致的参考数据集。(生物谷Bioon.com)
参考文献:
Beltran, A., Jiang, X., Shen, Y. et al. Site-saturation mutagenesis of 500 human protein domains. Nature (2025). doi:10.1038/s41586-024-08370-4
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


