肿瘤浸润淋巴细胞疗法将递交上市申请,Iovance股价腰斩
来源:医药魔方 2022-06-01 11:32
2021年5月,Iovance再次收到FDA要求提供lifileucel药效分析额外数据的回复函,以确保每一批TIL产品符合标准。
ovance Biotherapeutics报道了代号为C-144-01的积极研究结果,该研究旨在评估该公司主要候选药物lifileucel(肿瘤浸润淋巴细胞(TIL)疗法)在晚期(不可切除或转移性)黑色素瘤患者的疗效,这些患者既往接受过抗PD-1/L1治疗,如果BRAF突变阳性,也曾接受过BRAF或BRAF/MEK抑制剂治疗。

在注册性队列 4 (n=87) 中,独立审查委员会 (IRC) 使用RECIST 1.1标准评估的客观缓解率 (ORR) 为29% (95% 置信区间 (CI): 19.5%, 39.4%) ,3例为CR(完全缓解),22例PR(部分缓解)。中位缓解持续时间 (DOR) 为10.4个月,中位随访时间为23.5 个月。这些数据表明,一次性使用lifileucel治疗可能会为大量预处理的患者提供有意义的益处。
队列 4 的研究结果得到队列 2 (n=66) 的支持,IRC评估的ORR为35% (95% CI: 23.5%, 47.6%),5例CR和18例PR。队列 2 的中位DOR未达到,中位随访 时间为36.6个月。队列 2 和 4合并患者 (n=153) 的ORR为31% (95% CI: 24.1%, 39.4%),并且在中位研究随访27.6个月时未达到中位DOR。
两个队列的治疗中出现的不良事件特征与基础疾病和已知的非清髓性淋巴衰竭和白细胞介素-2 (IL-2)的不良事件特征一致,队列2和4之间也一致。
从患者入组情况来看,队列4患者的基线疾病负荷高于队列2患者,包括:基线乳酸脱氢酶(LDH)水平升高(众所周知的不良预后因素)的患者比例显著更高(64.4%vs 40.9%),以及基线时肿瘤病灶(有3个以上病灶比例,83.9% vs 65.2%)数量更多。此外,队列2的患者在lifileucel治疗前的抗PD-1治疗的累积时间大约是队列4的患者的一半。既往抗PD-1治疗的持续时间缩短与lifileucel的DOR增加相关。
Iovance表示将在今年8月递交该款产品的生物制品许可申请(BLA)。
Iovance公司是TIL技术的先驱,该技术是基于人体自身TIL,首先从患者体内获取肿瘤组织并提取TIL,然后在体外使用IL-2细胞因子刺激TIL扩增,之后将扩增的数10亿个TIL输注回患者体内,更有效地杀伤肿瘤细胞。
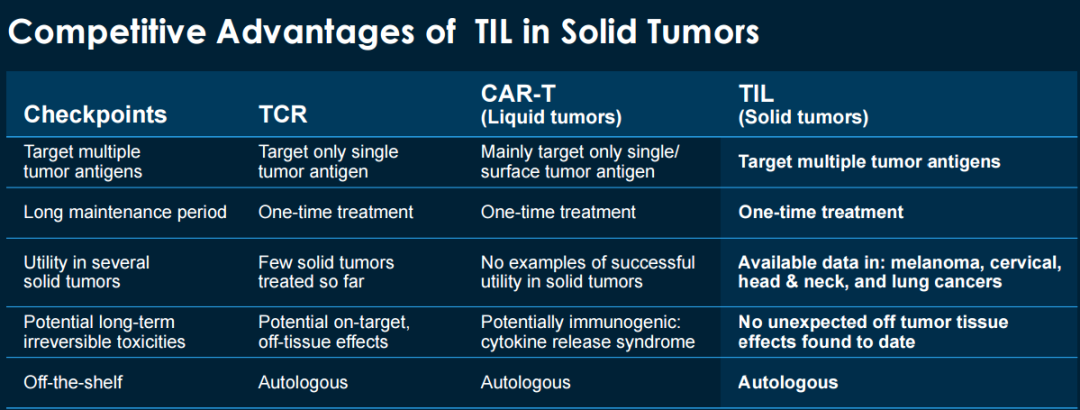
与现有疗法相比,TIL技术的优点包括:①可以靶向多种肿瘤抗原;②能够实现一次性治疗;③由于TIL来源自体,因此不良反应少。更重要的是基于这一细胞疗法技术开发的产品lifileucel目前已在包括黑色素瘤、宫颈癌、头颈部癌、肺癌实体瘤中显示出了疗效,有望成为首款上市的用于实体瘤的细胞疗法。
然而,Iovance关于lifileucel的开发进展并不顺利,lifileucel项目原计划在2020年底提交上市申请,然而2019年10月召开的会议上,Iovance未能就lifileucel治疗转移性黑色素瘤所需的效力分析与FDA达成一致,受此影响,lifileucel的上市申请计划从2020年底推迟至2021年。
2021年5月,Iovance再次收到FDA要求提供lifileucel药效分析额外数据的回复函,以确保每一批TIL产品符合标准。这一挫折使Iovance的BLA的提交推迟至2022年上半年。受此影响,Iovance股价下跌了6.79%,至26.97美元。
然而就在当天此消息发布不到20小时,该公司任职5年的首席执行官(CEO)Maria Fardis博士表示她将离职,这一离任令投资者感到恐慌,Iovance的股价因此下跌了36%,由26.97美元跌至17.22美元。
前两日披露的临床结果看来也并没有让投资人满意,本次结果公布导致Iovance股价腰斩,股价目前仅剩7.02美元。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


