Journal of Hepatology:复旦附属中山医院团队破解肝癌对PD-1抑制剂耐药之谜
来源:奇点糕 2022-03-24 16:24
免疫检查点阻断(ICB)治疗,尤其是PD-1/PD-L1抑制剂,给很多肿瘤患者带来了希望[3]。但是临床试验显示,PD-1抑制剂单药并没有给HCC患者带来显着的临床收益(临床试验注册号:KEYNOTE-240、CheckMate-459)。有研究表明,这很大程度上归因于肿瘤对PD-1抑制剂的耐药性[4,5]。所以我们迫切需要了解HCC
免疫检查点阻断(ICB)治疗,尤其是PD-1/PD-L1抑制剂,给很多肿瘤患者带来了希望[3]。但是临床试验显示,PD-1抑制剂单药并没有给HCC患者带来显着的临床收益(临床试验注册号:KEYNOTE-240、CheckMate-459)。
有研究表明,这很大程度上归因于肿瘤对PD-1抑制剂的耐药性[4,5]。所以我们迫切需要了解HCC耐药的机制,并寻找一种有效的联合治疗策略克服耐药,改善ICB疗法对HCC的疗效。
近日,由复旦大学附属中山医院樊嘉院士、柯爱武副研究员、蔡加彬博士领衔的研究团队在Journal of Hepatology期刊发表研究成果[6]。
他们发现对PD-1抑制剂有耐药性的HCC会上调表达转录因子ZFP64,随后ZFP64被蛋白磷酸化酶Cα(PKCα)活化,从而促进巨噬细胞集落刺激因子1(CSF1)的表达;而CSF1又会招募并促进巨噬细胞极化为促癌的M2表型,导致HCC的免疫逃逸并对PD-1抑制剂产生耐药。
好消息是,他们发现使用蛋白激酶抑制剂G?6976或仑伐替尼,可以阻断PKCα/ZFP64/CSF1轴,恢复HCC对PD-1抑制剂的敏感性。
接下来我们就一起来看看这个研究是如何展开的。
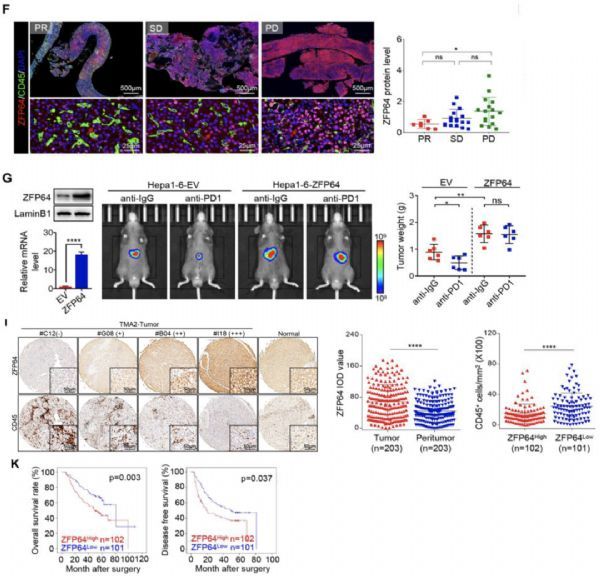
为了寻找对PD-1抑制剂治疗耐药HCC的特征,研究团队选取了10例接受PD-1抑制剂治疗后疾病进展(PD),7例部分应答(PR)的患者肝脏活检样本进行了NGS测序。
经过分析发现,ZFP64在疾病进展患者肿瘤组织中显着上调表达。在小鼠原位肿瘤模型中,若肿瘤细胞过表达ZFP64,则小鼠肿瘤生长更加迅速,对PD-1抑制剂治疗的响应更差。
在验证队列中,研究者发现ZFP64在肿瘤中显着上调,并且ZFP64的表达与肿瘤内浸润淋巴细胞的数量呈反比,ZFP64水平高与患者预后不良相关。这些数据提示,ZFP64可能是引起HCC免疫逃逸以及PD-1抑制剂耐药的关键因素。
为了在体内环境探究ZFP64对肿瘤发生发展的影响,樊院士团队使用一种能够自发肝细胞癌的HBV转基因小鼠模型。实验结果显示,若使小鼠肝细胞过表达ZFP64,则HCC发生率、生长速度、转移率都会显着增加。
对肿瘤微环境进行分析可见肿瘤中巨噬细胞明显增多,主要是促癌的M2巨噬细胞;但是,CD4+T以及CD8+T细胞显着减少。这些数据说明,ZFP64可以促进肿瘤的发生发展,并且诱导形成免疫抑制性的肿瘤微环境。
那么ZFP64是如何诱导M2型巨噬细胞增加的呢?
为了解答这个问题,研究者将巨噬细胞与ZFP64hi HCC细胞共培养,发现这可以促使巨噬细胞上调表达CD206、CD163 和Arg1等M2巨噬细胞的标志物,同时还会上调表达免疫抑制细胞因子IL-10和TGF-β1;共培养后的巨噬细胞可以强烈地抑制T细胞增殖与活化。此外,趋化实验还发现ZFP64hi HCC促进巨噬细胞的趋化募集。
以上的研究结果说明ZFP64hi HCC可以通过诱导巨噬细胞M2极化和促进巨噬细胞趋化募集两种机制,增加肿瘤内M2巨噬细胞数量。
那么ZFP64hi HCC细胞为什么能够招募并且诱导巨噬细胞M2极化呢?
由于ZFP64是一种转录因子,那么会不会是它调控了某种重要的基因表达,以此调控巨噬细胞呢?
为了证明上述猜测,研究者通过RNA测序以及ChIP-seq技术结合细胞系实验,寻找ZFP64的靶基因。最终发现,ZFP64可以促进CSF1的转录激活。
研究人员通过共培养实验发现,敲低肿瘤细胞的CSF1后,巨噬细胞的Arg1、IL-10和TGF-β1表达水平显着降低,并且趋化运动也减少。这些数据说明,ZFP64通过激活CSF1的转录,从而促进巨噬细胞的招募与M2极化。
那么ZFP64的活性又是受谁的调控呢?
接下来研究团队探究了ZFP64活性的调控机制,发现PKCα可以磷酸化ZFP64第226位丝氨酸,从而促进ZFP64核定位与转录激活能力。因此,PKCα、ZFP64和CSF1组成了一个完整的免疫逃逸信号轴。
对临床队列的回顾性研究发现,HCC患者PKCα/ZFP64/CSF1轴的激活与不良预后相关,并且与PD-1抑制剂治疗效果呈现负相关。
既然已经知道了以上的机制,那么临床上该怎么解决PKCα/ZFP64/CSF1轴引起的PD-1抑制剂耐药问题呢?
研究者尝试使用PKCα抑制剂G?6976抑制这条信号轴。他们发现,G?6976单药治疗就可以抑制肿瘤生长,并改善肿瘤免疫微环境。若是将G?6976与PD-1抑制剂联用,则可以取得更好的疗效。更为重要的是,研究者发现使用已经批准的多激酶抑制剂仑伐替尼与PD-1抑制剂联用,也能显着地改善治疗效果。
既然CSF1是PKCα/ZFP64/CSF1轴的最终效应因子,那么抑制CSF1信号是否能发挥很好的效果?为了探究这个可能性,研究人员使用CSF1R抑制剂BLZ945对荷瘤小鼠进行治疗,发现单用BLZ945就能很好的抑制肿瘤生长,若将其与PD-1抑制剂联用,则可以极大地改善PD-1抑制剂的疗效。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。