Cell Stem Cell:同济大学岳锐团队实现衰老造血干细胞的年轻化
来源:生物世界 2023-04-11 14:44
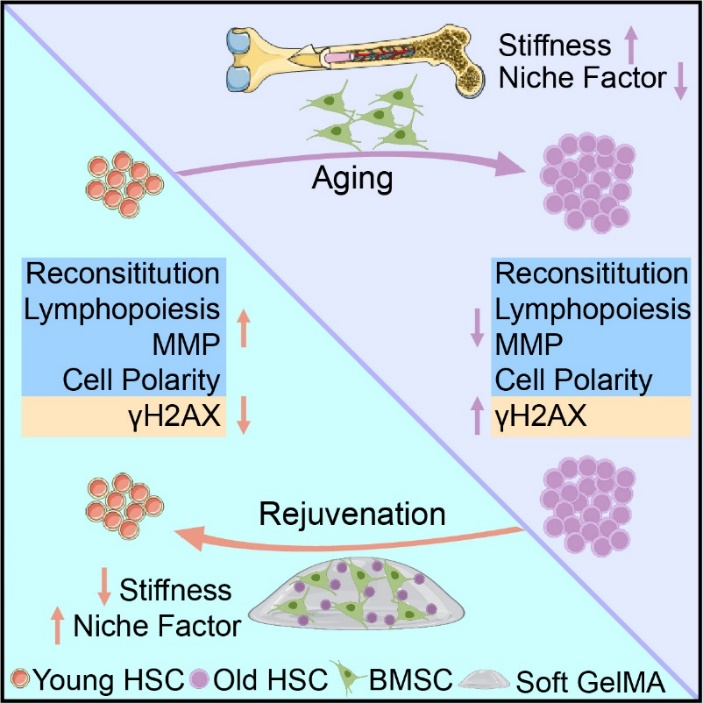
该研究揭示了基质硬度在调控骨髓造血微环境中的关键作用,并应用该原理在体外成功构建了柔软的年轻骨髓微环境用于HSC的维持和年轻化。此外,该研究还发现骨髓硬化是造血系统衰老的重要标志物。这一研究成果表明通
造血干细胞(Hematopoietic stem cell,HSC)具有自我更新和分化为所有下游血细胞的能力,在整个生命周期中不断为机体提供新鲜血液。在衰老过程中,HSC会发生髓系分化偏好、淋系分化减少、造血重建能力受损和克隆性造血等一系列变化,最终可能诱发免疫力低下、贫血或白血病等血液疾病,目前仍然缺乏有效逆转HSC衰老的方法。HSC的稳态维持和衰老与其所定位的骨髓微环境密切相关,其中LepR+骨髓基质细胞(Bone marrow stromal cell,BMSC)不仅可以分泌Scf和Cxcl12等因子维持HSC自我更新,而且富集骨骼干细胞从而调控成体骨骼稳态和损伤修复。骨髓微环境在衰老过程中会发生骨质疏松、脂肪积累、血管退变、神经与血管周细胞减少等现象,然而人们对于衰老骨髓的生物物理特性改变却知之甚少。此外,能否通过改变骨髓微环境逆转HSC衰老仍然存在争议。
2023年4月6日,同济大学生命科学与技术学院、附属东方医院再生医学研究所岳锐课题组在 Cell Stem Cell 期刊发表了题为:Harnessing matrix stiffness to engineer a bone marrow niche for hematopoietic stem cell rejuvenation 的研究论文,并获同期评述(Preview)。
该研究发现基质硬度密切调控骨髓造血微环境,并利用柔软的甲基丙烯酰化水凝胶(GelMA)构建了BMSC与HSC的体外3D共培养体系。该系统不仅可以促进HSC自我更新和淋系分化,而且能够显著逆转衰老HSC的各项功能指标。
此外,该研究还揭示了骨髓硬化是血液系统衰老的新型标志物。这一重要研究成果为衰老HSC年轻化以及衰老相关疾病治疗提供了新思路和新策略。

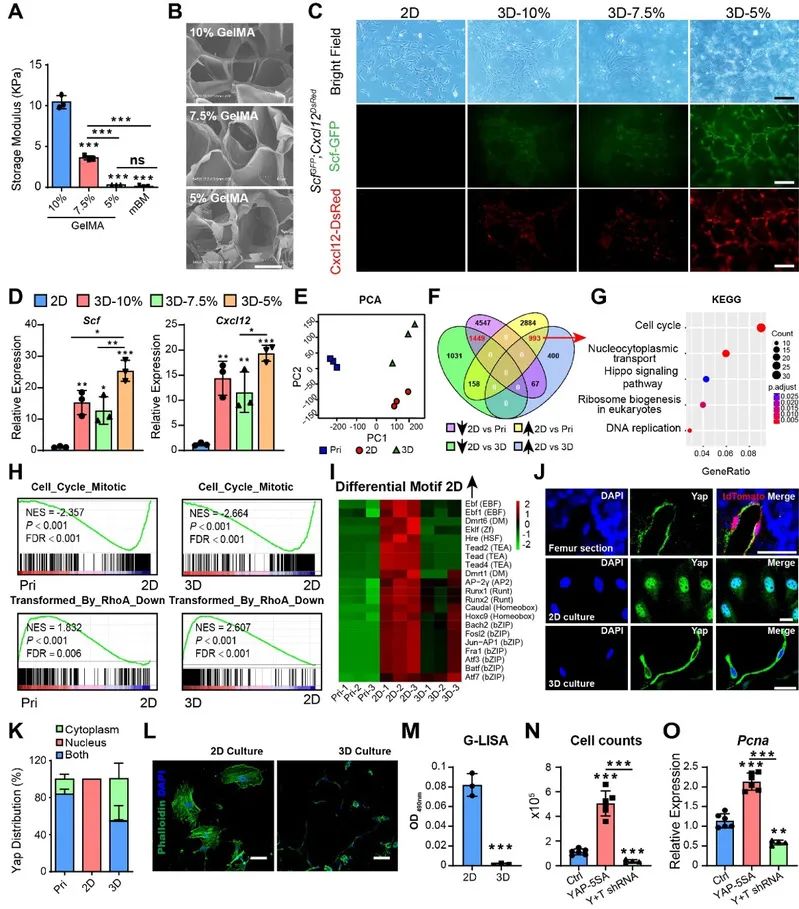 Yap/Taz感受硬度变化并调控BMSC增殖与HSC维持因子表达
Yap/Taz感受硬度变化并调控BMSC增殖与HSC维持因子表达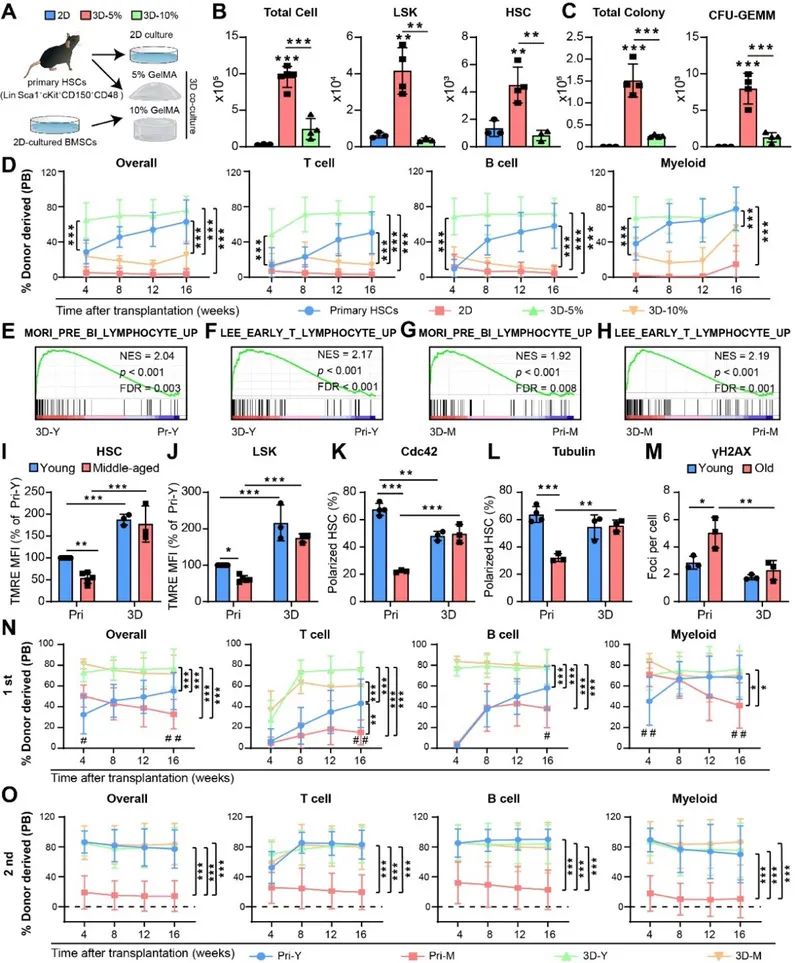 与BMSC进行体外3D共培养促进衰老HSC年轻化
与BMSC进行体外3D共培养促进衰老HSC年轻化
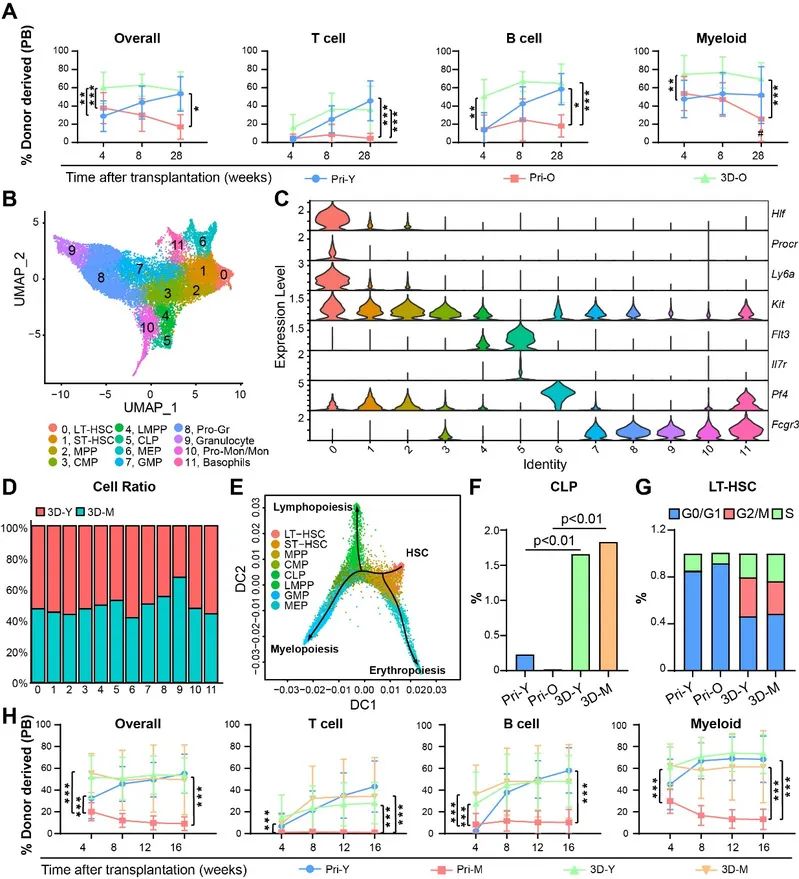
scRNA-seq分析与纯化后HSC移植
以上结果提示骨髓基质硬度可能密切调控HSC衰老。为了验证这一假设,研究者利用原子力显微镜对年轻、中年及年老小鼠长骨骨髓进行了原位测量,发现小鼠骨髓基质硬度随年龄的增长显著增加。他们通过对不同年龄段BMSC的scRNA-seq数据进行分析发现,Scf和Cxcl12表达伴随骨髓硬化显著下调,RhoA信号通路被显著激活。研究者还发现与年轻BMSC相比,年老BMSC中Yap/Taz核外分布的细胞比例减少,核内分布的细胞比例明显增加。以上数据表明衰老小鼠骨髓硬度增加,BMSC中Yap/Taz信号通路被激活,这可能与HSC维持因子下降和HSC衰老密切相关。
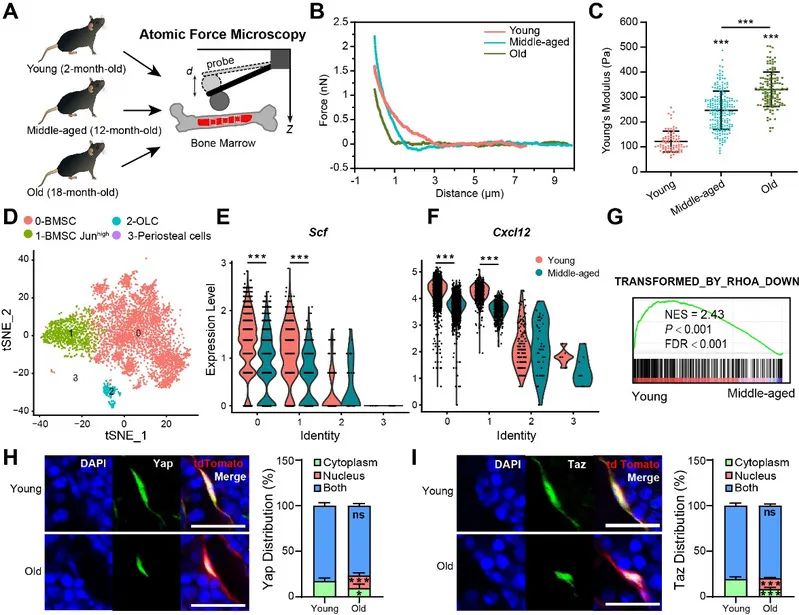
衰老伴随骨髓硬化和造血维持能力下降
综上所述,该研究揭示了基质硬度在调控骨髓造血微环境中的关键作用,并应用该原理在体外成功构建了柔软的年轻骨髓微环境用于HSC的维持和年轻化。此外,该研究还发现骨髓硬化是造血系统衰老的重要标志物。这一研究成果表明通过改变骨髓微环境逆转HSC衰老是一种行之有效的方法,从而为改善HSC质量、逆转机体系统性衰老和治疗重大血液疾病提供了创新策略。
该研究工作由同济大学岳锐教授指导完成,主要合作者包括华东理工大学王靖教授、中国科学院应用物理研究所王丽华研究员、同济大学高绍荣教授、高亚威教授和王启刚教授。同济大学研究生张潇颖、曹丹丹、徐丽婷和许艳华为论文共同第一作者。该研究获得了科技部国家重点研发计划,基金委面上和重大培育项目的大力支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


