Nat Commun丨张志刚/孙勇伟团队揭示SLIT2-ROBO1轴调控胰腺导管腺癌肝转移的进程
来源:网络 2023-02-24 15:21
肿瘤由原发癌转移至靶器官继而定植和生长是一个漫长且复杂的过程。在此过程中,虽然有数量庞大的散在肿瘤细胞(Disseminated tumor Cells,DTCs)散布入血液循环中,然而仅有其中的极少
肿瘤由原发癌转移至靶器官继而定植和生长是一个漫长且复杂的过程。在此过程中,虽然有数量庞大的散在肿瘤细胞(Disseminated tumor Cells,DTCs)散布入血液循环中,然而仅有其中的极少数可以顺利在靶器官定植且形成转移灶。根据肿瘤的“种子与土壤”学说,作为的“种子”肿瘤细胞需要挑选和改造作为“土壤”的转移灶微环境,而微环境也同时在影响和筛选肿瘤细胞,这是一个共同适应的过程【1】。仅在实现了共同适应的前提下,肿瘤的转移灶才得以顺利生长。依赖性受体(Dependence Receptors,DRs)是一类功能特殊的受体,其配体存在时,DRs会促进细胞的生存和增殖;在缺乏受体时,则会反过来诱导细胞的凋亡。一般认为依赖性受体的存在是机体为了维持稳态,防止细胞移动至异种器官内生长而进化出的防卫机制:细胞如果进入了缺乏对应配体的陌生微环境,其表达的DRs便会立即启动凋亡程序,将其消灭【2】。已经有多篇报道发现和探讨了DRs在肿瘤中扮演的重要角色,调控了肿瘤的发生和进展【3, 4】。
SLIT2是轴突导向因子配体家族的成员之一,它的生理功能众多且复杂,在生物发育,神经发生,肿瘤进程等过程中发挥了不可缺少的作用。SLIT2的经典受体是同为轴突导向因子的ROBO家族(ROBO1-4),该家族的分子均为单次跨膜的大蛋白,在SLIT2的结合后发挥调控细胞的迁移以及增殖等多项机能【5】。
2023年2月5日,张志刚课题组和仁济医院孙勇伟团队合作在Nature Communications杂志在线发表了标题为Coadaptation fostered by the SLIT2-ROBO1 axis facilitates liver metastasis of pancreatic ductal adenocarcinoma的研究论文。本研究阐明了ROBO1作为一个肿瘤细胞表面表达的依赖性受体,与肝细胞来源的SLIT2一同构建了胰腺导管腺癌肝脏转移前和转移后微环境的分子机制。

在本研究中,作者首先构建了脾脏注射导致胰腺导管腺癌细胞肝转移的小鼠模型,并对小鼠模型的肝脏转移前微环境(Premetastatic Niche,PMN)和转移后微环境(Macro metastatic Niche,MMN)进行了取样,并与正常肝脏一起进行了RNA-seq。结果显示SLIT2在肿瘤转移的PMN和MMN时期均高表达,且经过RNAscope实验在几种动物模型以及临床样本中确认SLIT2的来源为肝细胞(Hepatocyte)。作者经过继续研究发现肿瘤细胞膜定位的ROBO1也在SLIT2高度表达的转移灶富集,且两者的表达量随着肝转移的进程均呈现正相关。之后的研究中,作者发现ROBO1具有依赖性受体的特征,在没有SLIT2时,诱导表达自己的细胞凋亡,而在有SLIT2的微环境中可以促进肿瘤细胞进一步定植和生长,即机体所进化的防止ROBO1高表达的肿瘤细胞转移的机制反而被肿瘤微环境所利用,在肝脏中ROBO1成为了肿瘤的帮凶。进一步的机制研究阐明了,ROBO1在结合SLIT2后,可以为MEK3/6提供磷酸化p38MAKP的反应支架,使得其磷酸化的效率明显上升,以此快速激活下游通路,促进肿瘤生长。而ROBO1的中和性抗体可以阻断SLIT2-ROBO1轴:在无法结合SLIT2的情况下,ROBO1不仅不能促进肿瘤细胞生长,更可以发挥依赖性受体的特性诱导肿瘤细胞凋亡。以上工作为胰腺癌肝转移的靶向治疗提供了新的思路。
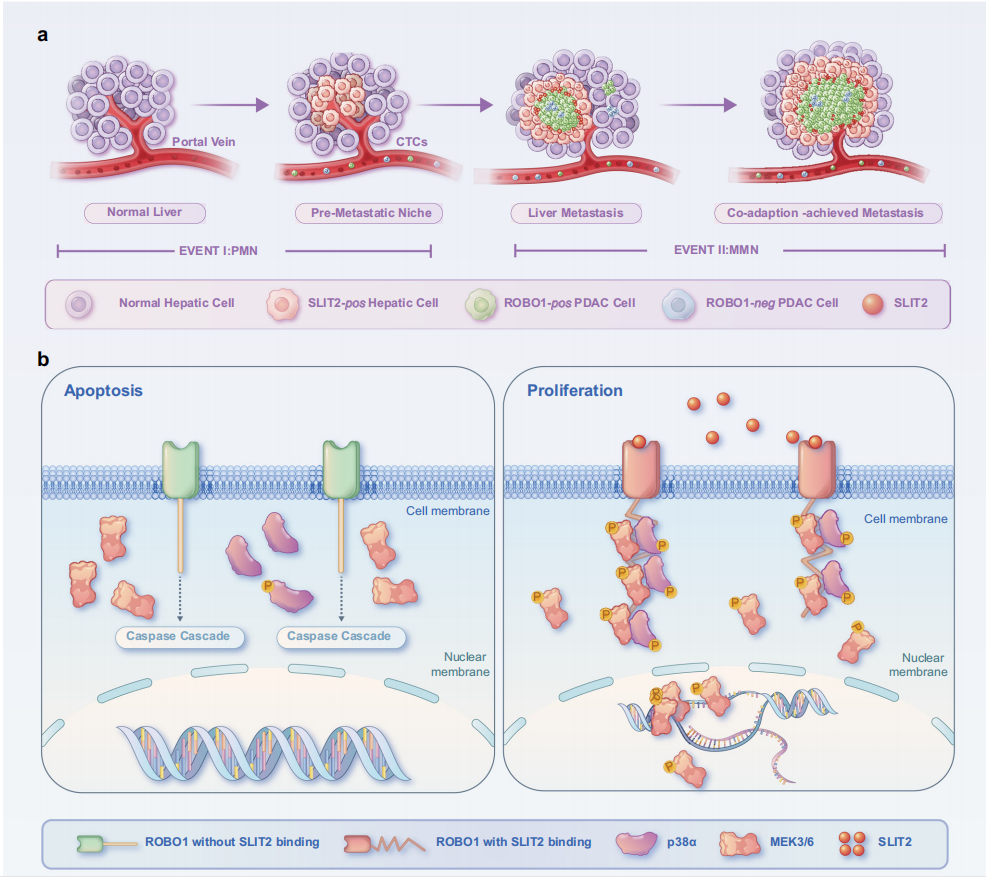
李庆博士、张小昕博士、胡立鹏博士和倪博博士为该论文的共同第一作者。张志刚研究员,李军副研究员和孙勇伟主任为该论文的共同通讯作者。
原文链接:
https://doi.org/10.1038/s41467-023-36521-0
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


