Nature:原始生殖细胞的抑制性基因调控具有性别特异性
来源:本站原创 2021-12-19 14:22
在一项新的研究中,来自英国帝国理工学院和伦敦医学科学研究所的研究人员首次发现注定成为卵子或精子的胚胎生殖细胞依赖于不同的抑制性基因调控方法。相关研究结果于2021年12月8日在线发表在Nature期刊上,论文标题为“Sex-specific chromatin remodelling safeguards t
2021年12月19日讯/生物谷BIOON/---在一项新的研究中,来自英国帝国理工学院和伦敦医学科学研究所的研究人员首次发现注定成为卵子或精子的胚胎生殖细胞依赖于不同的抑制性基因调控方法。相关研究结果于2021年12月8日在线发表在Nature期刊上,论文标题为“Sex-specific chromatin remodelling safeguards transcription in germ cells”。

为了使一个基因能够被细胞表达,编码该基因的DNA需要开放,并能被特定的蛋白访问。这意味着DNA的压缩程度直接影响到一个基因是否会被激活。
作为一种化学修饰,甲基化是细胞用来沉默基因表达的一种表观遗传控制形式。它通过增加局部的DNA压缩来实现这一目的。甲基化直接发生在DNA本身,通过对胞嘧啶(DNA的组成成分之一)的甲基化;也可直接发生在细胞核内包裹DNA的组蛋白上。
在发育过程中,原始生殖细胞(PGC,配子的胚胎细胞前体)在分化成卵子或精子之前几乎失去了所有的DNA甲基化。这让科学家们猜测这些早期生殖细胞如何调节它们的基因表达,特别是它们使用什么机制来沉默那些不应该活跃的基因。
全局DNA去甲基化
为了回答这个问题,论文通讯作者、伦敦医学科学研究所的Petra Hajkova教授及其团队分析了PGC在经历了全局DNA去甲基化后发生的基因抑制模式。他们发现,这些生殖细胞使用了其他的抑制性表观遗传系统,关键的是,这些系统在雄性和雌性生殖细胞中的使用方式不同。
这些结果表明,组蛋白3上的K27甲基化可以补偿PCG中DNA甲基化的丢失,而且是以一种性别特异性的方式进行。雌性生殖细胞严重依赖这一系统,而雄性生殖细胞还利用了组蛋白3上K9的甲基化。
为了在生理背景下进一步探索这个问题,Hajkova团队分析了一种小鼠模型,在这种模型中,K27甲基化所需的基因Ezh2已经被移除。他们看到,如果没有EZH2,雌性生殖细胞以一种不受控制的方式表达基因,不能分化并随后死亡。
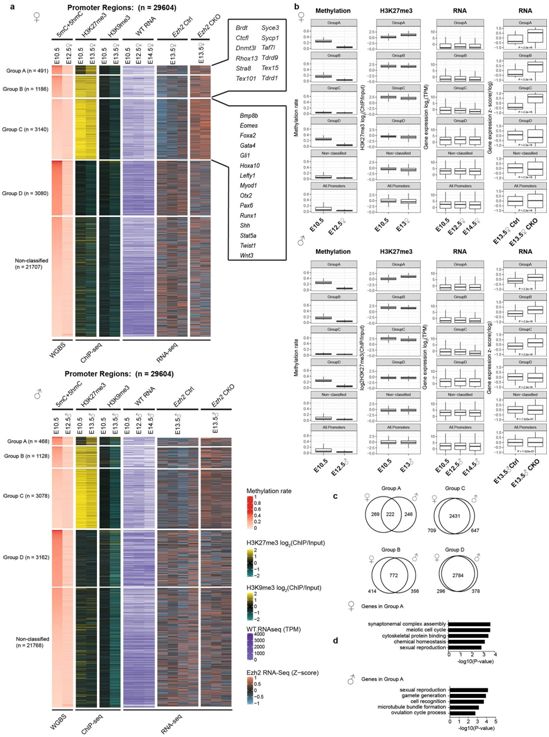
性腺重编程过程中启动子DNA甲基化、H3K9me3和H3K27me3的动态变化,图片来自Nature, 2021, doi:10.1038/s41586-021-04208-5。
有趣的是,雄性PCG没有受到影响。这支持了一个想法,即在这一发育阶段,有一种平行的抑制性基因控制机制在雄性生殖细胞中发挥作用。
这些研究结果为PGC在没有DNA甲基化的情况下如何调节它们的基因提供了新的见解。它首次表明,在生殖细胞发育的这一阶段,抑制性基因调控具有性别特异性。
揭示病变细胞的脆弱性
论文第一作者、Hajkova团队博士后研究员Tien-Chi Huang博士说,“表观遗传重编程是生命周期中一种高度协调的过程。我们的研究提供了一个期待已久的答案,以了解在这一过程中细胞如何协调不同层次的控制以维持基因表达。”
Hajkova教授说,“这些结果告诉我们一些关于基因表达控制的基本知识。我们所看到的对胚胎生殖细胞发育的研究具有更广泛的影响,因为我们知道一些人类病症的特点是DNA甲基化的全局性减少。这意味着我们的研究结果为了解患病细胞需要依赖什么提供了有价值的见解,揭示了它们的潜在脆弱性。”(生物谷 Bioon.com)
参考资料:
Tien-Chi Huang et al. Sex-specific chromatin remodelling safeguards transcription in germ cells. Nature, 2021, doi:10.1038/s41586-021-04208-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


