FDA拒绝批准口腔粘膜炎新药上市
来源:医药魔方 2023-08-10 13:08
8月9日,Galera Therapeutics宣布收到FDA就Avasopasem manganese(Avasopasem,GC4419)用于治疗接受标准治疗的头颈癌(HNC)患者因放疗引起的严重
8月9日,Galera Therapeutics宣布收到FDA就Avasopasem manganese(Avasopasem,GC4419)用于治疗接受标准治疗的头颈癌(HNC)患者因放疗引起的严重口腔粘膜炎(SOM)的新药上市申请(NDA)发出的完整回复函(CRL)。

FDA在CRL中表示,III期ROMAN研究以及IIb期GT-201研究数据不足以证明Avasopasem在减少头颈癌患者严重口腔黏膜炎方面的有效性与安全性。FDA认为,需要重新递交额外的临床试验结果。
Avasopasem是一种选择性小分子歧化酶模拟物,目前已开发的适应症包括晚期头颈癌(HNC)、放疗诱发的严重口腔粘膜炎(SOM)、放化疗诱发的食管炎等。此前,FDA曾授予Avasopasem突破性疗法和快速通道资格认定,用于减少放化疗诱发的SOM。
本次NDA该公司提交了包括随机、双盲、安慰剂对照的III期ROMAN研究和IIb期GT-201研究数据。新闻稿指出,两项试验都证明了接受Avasopasem治疗后的患者SOM疾病负担关键性指标出现了具有临床意义的缓解,包括SOM发生率和天数、SOM严重程度(4级口腔黏膜炎发病率、不能进食或饮水)的缓解,以及SOM发病时间的延迟。
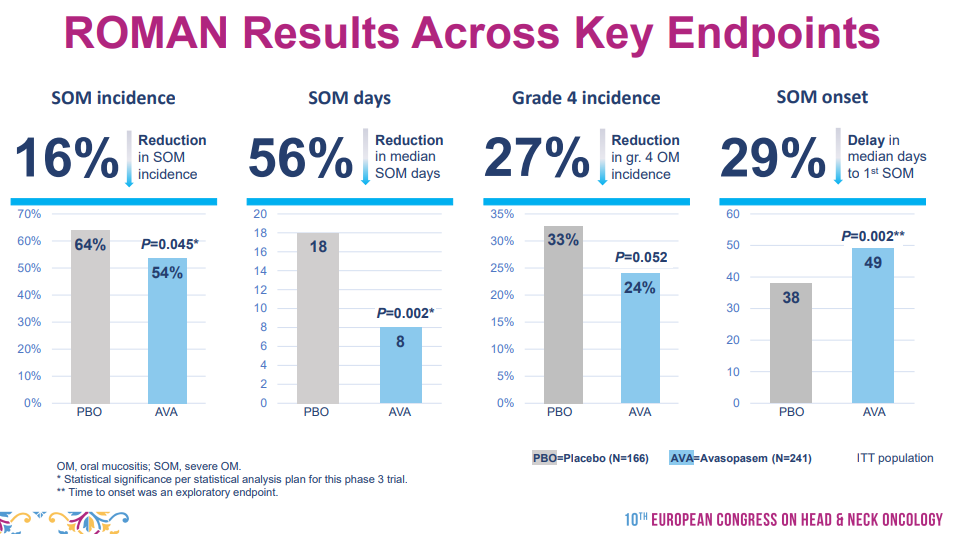 ROMAN研究结果(来源:Galera官网)
ROMAN研究结果(来源:Galera官网)
SOM是口腔和咽喉粘膜的急性炎症,该病患者无法进食固体食物或饮用液体,是放疗的一种常见的毒副作用,而放疗是头颈癌的标准治疗方法。在美国,每年大约有4.2万名头颈癌患者接受标准放疗,大约70%的患者在治疗期间会发生SOM。中断放射治疗可以缓解SOM,但这会对患者原本良好的肿瘤预后产生不利影响。在Avasopasem之前,美国没有针对这类患者的SOM疗法获批上市。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


