1篇Nature和1篇Cell论文揭示与帕金森病相关的蛋白LRRK2作用机制
来源:本站原创 2020-08-26 07:17
2020年8月26日讯/生物谷BIOON/---一种难以捉摸的蛋白被许多人认为是全面了解遗传性帕金森病病因的关键,而且如今却更加清晰地成为人们关注的焦点。帕金森病影响着全世界数以百万计的人,它是一种神经系统疾病,会逐渐攻击运动功能,导致运动和协调等方面的持久损害。研究这种疾病的主要原因的科学家们将重点放在这种称为富含亮氨酸重复激酶2(leucine-rich
2020年8月26日讯/生物谷BIOON/---一种难以捉摸的蛋白被许多人认为是全面了解遗传性帕金森病病因的关键,而且如今却更加清晰地成为人们关注的焦点。
帕金森病影响着全世界数以百万计的人,它是一种神经系统疾病,会逐渐攻击运动功能,导致运动和协调等方面的持久损害。
研究这种疾病的主要原因的科学家们将重点放在这种称为富含亮氨酸重复激酶2(leucine-rich repeat kinase 2, LRRK2)的蛋白的突变上。由于缺乏有关这种蛋白结构的信息,理解LRRK2如何破坏正常功能一直很困难。鉴于LRRK2是一个主要的药物靶点,破译LRRK2结构的努力甚至包括将样品发射到太空,以此利用微重力条件帮助蛋白样品结晶,但没有取得成功。
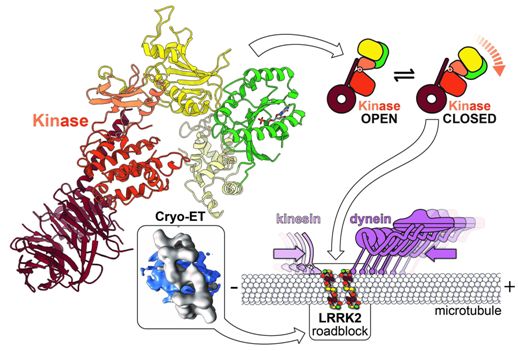
如今,来自美国加州大学圣地亚哥分校等研究机构的研究人员利用前沿的技术构建出LRRK2在它的自然细胞环境内的首批可视化图,以及这种蛋白的第一张高分辨率蓝图。他们利用这些图来描述LRRK2如何与称为微管的细胞轨道结合,并作为沿着这些轨道移动的分子马达的路障起作用。相关研究结果以两篇论文的形式分别于2020年8月19日和2020年8月11日在线发表在Nature期刊和Cell期刊上,论文标题分别为“Structure of LRRK2 in Parkinson’s disease and model for microtubule interaction”和“The In Situ Structure of Parkinson’s Disease-Linked LRRK2”。
加州大学圣地亚哥分校生物科学院长Kit Pogliano博士说,“考虑到帕金森病影响了许多人的生活,这两篇论文朝着开发更有效的帕金森病治疗方法迈出了巨大的一步。将低温电镜(cryo-EM)与活细胞成像相结合,这些研究人员可以观察到这种蛋白在细胞内的作用机制,并更迅速地确定潜在的药物如何影响它的功能。这将加速药物发现,并为患有这种衰弱疾病的人提供新的希望。”
LRRK2:帕金森病的关键治疗靶点
作为一种激酶,LRRK2是将磷酸化学标签添加到其他蛋白上,影响它们的功能。LRRK2突变是遗传性帕金森病的主要原因,但是科学家们并不完全了解这种酶在正常或疾病状态下的功能。
人们一直在大力寻求此类问题的答案,特别是因为激酶是最成熟的药物治疗靶点之一。自2004年LRRK2基因首次被克隆以来,人们已经投入了巨大的努力,将它作为帕金森病的治疗靶点。
世界著名的激酶权威Susan Taylor认识到,加州大学圣地亚哥分校的专业知识非常适合解决这一问题。在迈克尔-福克斯基金会的支持下,一个包括加州大学圣地亚哥分校研究人员在内的国际团队开始利用新技术研究LRRK2。
LRRK2在微管上的细胞蓝图
正如这篇Cell论文中所描述的那样,由Elizabeth Villa博士及其同事领导的加州大学圣地亚哥分校研究人员利用称为低温电子断层扫描(cryo-electron tomography, cryo-ET)的新突破性技术,即低温电镜(cryo-EM)的一种新模式,来观察在细胞内自然环境下的LRRK2,并在以前未观察到的水平上描述它的结构。
在许多情况下,当人们试图确定一种蛋白的结构时,他们首先要在细胞外分离这种蛋白。当使用cryo-EM时,科学家们将蛋白分子冷冻在薄薄的冰层中,保存它的结构,并在高分辨率下确定它的结构。而Villa的研究团队则对含有被研究蛋白分子的冷冻细胞进行成像,从不同角度拍照,有点像CAT扫描。
Villa说,“我们打开引擎盖,观察细胞内部在细胞的不同位置相互作用的冷冻分子。我们使用电子和离子束,就像一把光剑一样,将细胞的部分区域轰开。在中间我们留下了一个窗口,里面有我们有兴趣观察的蛋白分子。”
这些研究人员还使用光学显微镜来寻找细胞内的蛋白分子,并使用先进的计算建模工具来开发LRRK2突变体的高分辨率综合模型。他们的数据揭示了LRRK2与称为微管的细胞高速公路的结合,以令人惊讶的规则和意想不到的几何形状装饰微管,并预测LRRK2的激酶活性类似于帕金森病中已知的“超速”状态。
Villa说,“这种强大的新技术组合在这项研究中首次应用,并使得我们有可能首次观察到LRRK2突变体的结构,另外还得益于它的细胞环境。据我们所知,这是使用传统生化工具之前在细胞内测定的人类蛋白的最高分辨率结构。我们正在将结构带入细胞生物学。”
LRRK2的分子蓝图
为了了解LRRK2如何在化学水平上工作,并设计治疗方法,需要更高的分辨率结构来揭示原子的位置以及它们如何与潜在的药物相互作用。在这篇Nature论文中,论文通讯作者Samara Reck-Peterson博士和Andres Leschziner博士更深入地研究了LRRK2的结构和功能,并与Villa团队合作确定了LRRK2如何与微管相互作用。
Leschziner团队利用cryo-EM,在原子水平下捕捉到了迄今为止LRRK2结构最详细的图片。德国法兰克福歌德大学教授Stefan Knapp和他的团队在决定如何让LRRK2易于进行结构研究时也发挥了重要作用。这种结果包括这种蛋白的业务端--包括利用磷酸基团标记其他蛋白的部分。在这种结构中发现了所有主要帕金森病致病突变的位置。
接下来,Leschziner团队将他们的结构与Villa的结构结合起来,并提出一种解释LRRK2如何与微管结合的模型。
Leschziner说,“你可以认为LRRK2的激酶部分有点像吃豆人,它可以是开放的,也可以是封闭的。我们的建模表明,当与微管结合时,这种激酶需要处于封闭状态,这表明这种激酶的形状可能会调节LRRK2与微管的结合。与Reck-Peterson实验室合作,我们决定直接测试这种模型。”
LRRK2是分子马达的路障
Reck-Peterson擅长研究微管。她和她的团队对沿微管运输货物的分子马达感兴趣,以及这种运输的缺陷如何导致人类神经发育和神经退行性疾病。Reck-Peterson和她的团队想知道LRRK2与微管的相互作用是否会对在微管上移动并将重要的货物运送到细胞中的分子机器造成损害。
她的团队发现,LRRK2会制造路障,阻止这些分子机器的运转。他们还表明,一些靶向LRRK2激酶的药物会增强这种效果,而其他药物则会减弱这种效果。虽然Leschziner和Reck-Peterson还不能确定这些路障是否在帕金森病中发挥作用,但是他们的发现已经对设计通过抑制LRRK2发挥作用的治疗性药物产生了影响。他们的研究指出关闭LRRK2激酶结构域的激酶抑制剂可能会导致阻断分子马达移动的有害影响。
Reck-Peterson说,“目前还不清楚LRRK2-微管结合在帕金森病中发挥何种作用。但是我们如今拥有的是细胞蓝图和分子蓝图,这才是弄清LRRK2的作用并微调针对LRRK2的治疗性药物所需要的。”(生物谷 Bioon.com)
参考资料:
1.C. K. Deniston et al. Structure of LRRK2 in Parkinson’s disease and model for microtubule interaction. Nature, 2020, doi:10.1038/s41586-020-2673-2.
2.Reika Watanabe et al. The In Situ Structure of Parkinson’s Disease-Linked LRRK2. Cell, 2020, doi:10.1016/j.cell.2020.08.004.
3.Leading-edge Technology Unmasks Protein Linked to Parkinson’s Disease
https://ucsdnews.ucsd.edu/pressrelease/leading-edge-technology-unmasks-protein-linked-to-parkinsons-disease
帕金森病影响着全世界数以百万计的人,它是一种神经系统疾病,会逐渐攻击运动功能,导致运动和协调等方面的持久损害。
研究这种疾病的主要原因的科学家们将重点放在这种称为富含亮氨酸重复激酶2(leucine-rich repeat kinase 2, LRRK2)的蛋白的突变上。由于缺乏有关这种蛋白结构的信息,理解LRRK2如何破坏正常功能一直很困难。鉴于LRRK2是一个主要的药物靶点,破译LRRK2结构的努力甚至包括将样品发射到太空,以此利用微重力条件帮助蛋白样品结晶,但没有取得成功。
如今,来自美国加州大学圣地亚哥分校等研究机构的研究人员利用前沿的技术构建出LRRK2在它的自然细胞环境内的首批可视化图,以及这种蛋白的第一张高分辨率蓝图。他们利用这些图来描述LRRK2如何与称为微管的细胞轨道结合,并作为沿着这些轨道移动的分子马达的路障起作用。相关研究结果以两篇论文的形式分别于2020年8月19日和2020年8月11日在线发表在Nature期刊和Cell期刊上,论文标题分别为“Structure of LRRK2 in Parkinson’s disease and model for microtubule interaction”和“The In Situ Structure of Parkinson’s Disease-Linked LRRK2”。

图片来自Reck-Peterson and Leschziner Labs, UC San Diego。
加州大学圣地亚哥分校生物科学院长Kit Pogliano博士说,“考虑到帕金森病影响了许多人的生活,这两篇论文朝着开发更有效的帕金森病治疗方法迈出了巨大的一步。将低温电镜(cryo-EM)与活细胞成像相结合,这些研究人员可以观察到这种蛋白在细胞内的作用机制,并更迅速地确定潜在的药物如何影响它的功能。这将加速药物发现,并为患有这种衰弱疾病的人提供新的希望。”
LRRK2:帕金森病的关键治疗靶点
作为一种激酶,LRRK2是将磷酸化学标签添加到其他蛋白上,影响它们的功能。LRRK2突变是遗传性帕金森病的主要原因,但是科学家们并不完全了解这种酶在正常或疾病状态下的功能。
人们一直在大力寻求此类问题的答案,特别是因为激酶是最成熟的药物治疗靶点之一。自2004年LRRK2基因首次被克隆以来,人们已经投入了巨大的努力,将它作为帕金森病的治疗靶点。
世界著名的激酶权威Susan Taylor认识到,加州大学圣地亚哥分校的专业知识非常适合解决这一问题。在迈克尔-福克斯基金会的支持下,一个包括加州大学圣地亚哥分校研究人员在内的国际团队开始利用新技术研究LRRK2。
LRRK2在微管上的细胞蓝图
正如这篇Cell论文中所描述的那样,由Elizabeth Villa博士及其同事领导的加州大学圣地亚哥分校研究人员利用称为低温电子断层扫描(cryo-electron tomography, cryo-ET)的新突破性技术,即低温电镜(cryo-EM)的一种新模式,来观察在细胞内自然环境下的LRRK2,并在以前未观察到的水平上描述它的结构。
在许多情况下,当人们试图确定一种蛋白的结构时,他们首先要在细胞外分离这种蛋白。当使用cryo-EM时,科学家们将蛋白分子冷冻在薄薄的冰层中,保存它的结构,并在高分辨率下确定它的结构。而Villa的研究团队则对含有被研究蛋白分子的冷冻细胞进行成像,从不同角度拍照,有点像CAT扫描。
Villa说,“我们打开引擎盖,观察细胞内部在细胞的不同位置相互作用的冷冻分子。我们使用电子和离子束,就像一把光剑一样,将细胞的部分区域轰开。在中间我们留下了一个窗口,里面有我们有兴趣观察的蛋白分子。”
这些研究人员还使用光学显微镜来寻找细胞内的蛋白分子,并使用先进的计算建模工具来开发LRRK2突变体的高分辨率综合模型。他们的数据揭示了LRRK2与称为微管的细胞高速公路的结合,以令人惊讶的规则和意想不到的几何形状装饰微管,并预测LRRK2的激酶活性类似于帕金森病中已知的“超速”状态。
Villa说,“这种强大的新技术组合在这项研究中首次应用,并使得我们有可能首次观察到LRRK2突变体的结构,另外还得益于它的细胞环境。据我们所知,这是使用传统生化工具之前在细胞内测定的人类蛋白的最高分辨率结构。我们正在将结构带入细胞生物学。”
LRRK2的分子蓝图
为了了解LRRK2如何在化学水平上工作,并设计治疗方法,需要更高的分辨率结构来揭示原子的位置以及它们如何与潜在的药物相互作用。在这篇Nature论文中,论文通讯作者Samara Reck-Peterson博士和Andres Leschziner博士更深入地研究了LRRK2的结构和功能,并与Villa团队合作确定了LRRK2如何与微管相互作用。
Leschziner团队利用cryo-EM,在原子水平下捕捉到了迄今为止LRRK2结构最详细的图片。德国法兰克福歌德大学教授Stefan Knapp和他的团队在决定如何让LRRK2易于进行结构研究时也发挥了重要作用。这种结果包括这种蛋白的业务端--包括利用磷酸基团标记其他蛋白的部分。在这种结构中发现了所有主要帕金森病致病突变的位置。
接下来,Leschziner团队将他们的结构与Villa的结构结合起来,并提出一种解释LRRK2如何与微管结合的模型。
Leschziner说,“你可以认为LRRK2的激酶部分有点像吃豆人,它可以是开放的,也可以是封闭的。我们的建模表明,当与微管结合时,这种激酶需要处于封闭状态,这表明这种激酶的形状可能会调节LRRK2与微管的结合。与Reck-Peterson实验室合作,我们决定直接测试这种模型。”
LRRK2是分子马达的路障
Reck-Peterson擅长研究微管。她和她的团队对沿微管运输货物的分子马达感兴趣,以及这种运输的缺陷如何导致人类神经发育和神经退行性疾病。Reck-Peterson和她的团队想知道LRRK2与微管的相互作用是否会对在微管上移动并将重要的货物运送到细胞中的分子机器造成损害。
她的团队发现,LRRK2会制造路障,阻止这些分子机器的运转。他们还表明,一些靶向LRRK2激酶的药物会增强这种效果,而其他药物则会减弱这种效果。虽然Leschziner和Reck-Peterson还不能确定这些路障是否在帕金森病中发挥作用,但是他们的发现已经对设计通过抑制LRRK2发挥作用的治疗性药物产生了影响。他们的研究指出关闭LRRK2激酶结构域的激酶抑制剂可能会导致阻断分子马达移动的有害影响。
Reck-Peterson说,“目前还不清楚LRRK2-微管结合在帕金森病中发挥何种作用。但是我们如今拥有的是细胞蓝图和分子蓝图,这才是弄清LRRK2的作用并微调针对LRRK2的治疗性药物所需要的。”(生物谷 Bioon.com)
参考资料:
1.C. K. Deniston et al. Structure of LRRK2 in Parkinson’s disease and model for microtubule interaction. Nature, 2020, doi:10.1038/s41586-020-2673-2.
2.Reika Watanabe et al. The In Situ Structure of Parkinson’s Disease-Linked LRRK2. Cell, 2020, doi:10.1016/j.cell.2020.08.004.
3.Leading-edge Technology Unmasks Protein Linked to Parkinson’s Disease
https://ucsdnews.ucsd.edu/pressrelease/leading-edge-technology-unmasks-protein-linked-to-parkinsons-disease
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


