《细胞》:癌基因突变促癌的“暗箱操作”被华人科学家“曝光”了
来源: 奇点糕 2022-05-22 08:46
基因组学研究发现了能够导致肿瘤发生和进展的基因突变。
基因组学研究发现了能够导致肿瘤发生和进展的基因突变。
部分致癌突变会产生具有新活性的蛋白,能够与其他蛋白产生新的相互作用,从而发挥原蛋白所不具有的功能。
如果能高通量地鉴定这种突变体产生的新蛋白间相互作用(neoPPIs),必然将为精准靶向药物开发带来极大便利。
5月4日,来自埃默里大学医学院的傅海安教授团队在《细胞》杂志发表重要研究成果[1]。他们开发了一个高通量筛选平台——qHT-dS,能够鉴定突变体蛋白介导的neoPPIs。基于qHT-dS,研究人员发现高频致癌突变BRAFV600E能够与KEAP1产生neoPPI,激活NRF2介导的氧化还原途径。
虽然之前有研究表明,KEAP1-NRF2通路能够清除细胞内的活性氧,帮助肿瘤细胞应对氧化应激,从而促进肿瘤细胞的生存和耐药[2];但是物极必反,研究人员发现这一通路的激活暴露了肿瘤细胞的一个弱点,即对由NRF2调控的抗氧化因子——NAD(P)H:醌氧化还原酶1(NQO1)的特异性毒性底物格外敏感,从而提供了治疗靶点。
这项研究证明了肿瘤基因改变能够产生新的蛋白间相互作用,为突变体指导的精准医学治疗提供了新策略。

论文首页截图
基因的错义突变会产生新表位,可能改变编码蛋白的内在特性,诱导新的互作或减弱原有的互作。这种新表位诱发的差异蛋白互作(Df-PPIs)可能会重塑致癌通路,从而影响肿瘤的生物学行为。
即便是同一基因,不同的突变位点对肿瘤生物学行为的影响也不同[2]。在氨基酸水平研究突变体的临床意义,既是挑战也是精准医疗的需要。
此外,编码转接体蛋白和抑癌蛋白的基因突变是难以直接靶向的,这些蛋白主要通过与其他蛋白互作发挥功能[3],因此了解突变体如何改变蛋白互作网络,将为治疗提供下游靶点。
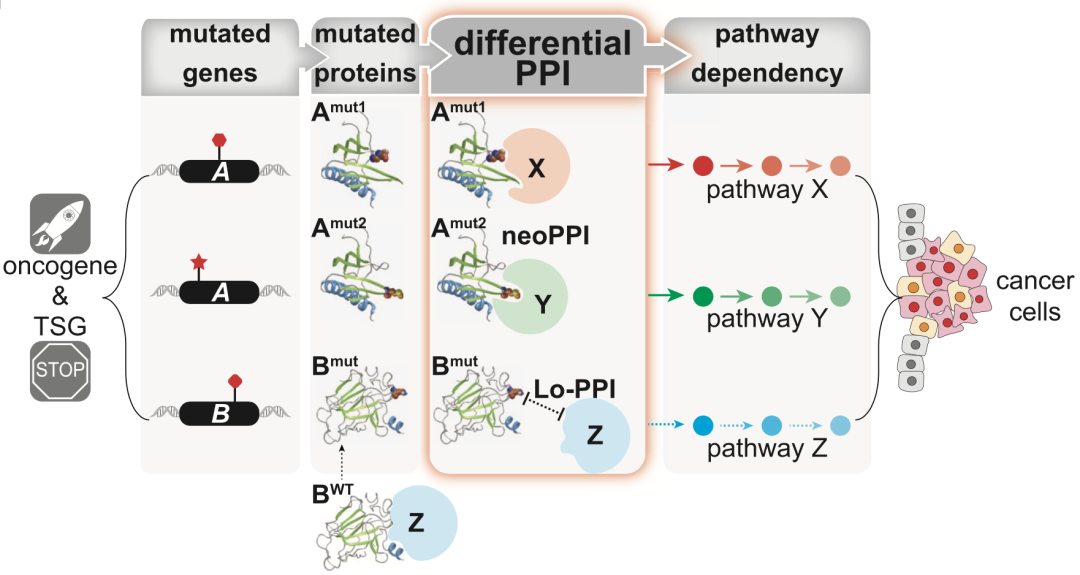
基因突变可能会改写下游信号通路
目前突变诱发neoPPIs的频率和图谱还没有建立,主要的障碍是如何在活细胞中系统性地研究这些相互作用。为了解决这一问题,研究者们建立了一种基于生物发光共振能量转移(BRETn)技术的平台qHT-dS,能够在活细胞中高通量、定量地筛选产生neoPPIs的基因突变位点。
为了针对性地研究致癌基因突变编码蛋白和癌症相关蛋白的相互作用,研究人员先是筛选了18个致癌突变位点(包括2个致癌基因和4个抑癌基因)和556个野生型癌症相关基因,构建了过表达文库。
之后,研究人员在1536孔板上建立了基于BRETn的超高通量PPI筛选体系:在HEK293T细胞中转染带有Nanoluc荧光素标签的野生型(WT)或突变型(MUT)致癌基因表达质粒,作为BRETn的供者;转染带有Venus荧光蛋白标签的癌症相关基因表达质粒,作为BRETn的受者。要产生阳性的BRETn信号,供者和受者间距离需要小于10nm,因此能够准确反应蛋白之间的直接作用。
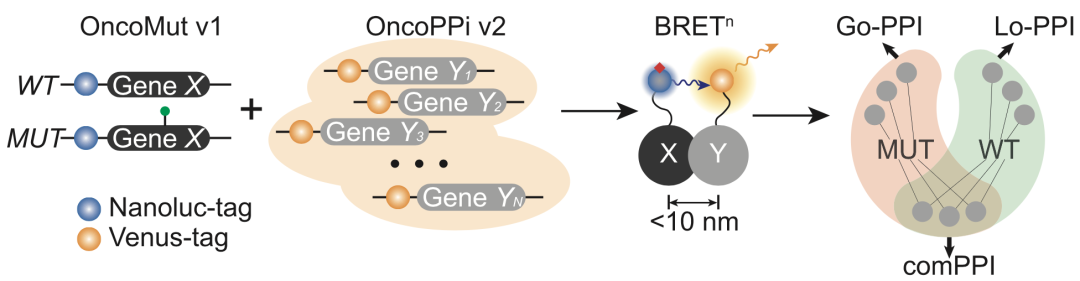
qHT-dS平台技术路线图
通过自动化的工作流程,研究者们系统地测试了18个突变体蛋白及其对应的6个野生型蛋白与556种癌症相关蛋白的两两相互作用,并通过自主开发的互作重塑比较分析算法(CARINA)鉴定出了8839个蛋白互作。
紧接着,研究人员用较为严格的标准筛选出高标准差异蛋白互作(HS-Df-PPIs),其中包括突变体相对于野生型增加的蛋白互作(HS-Go-PPIs)359个、减少的蛋白互作(HS-Lo-PPIs)13个。
如果从致癌基因角度分析这些HS-Df-PPIs,会发现同一基因的不同突变位点,甚至是同一突变位点的不同氨基酸残基改变,所导致的PPI网络变化都有很大差异。这一结果印证了在氨基酸残基水平研究突变体意义的必要性。
此外,抑癌基因突变既有HS-Lo-PPI又有HS-Go-PPI,说明抑癌基因的突变不仅导致抑癌功能的失活,也会使其获得新的活性。而致癌基因突变以Go-PPI为主,说明致癌基因突变可能重塑致癌通路或引起其他通路变化。
而从癌症相关蛋白的角度分析,可以发现35%的HS-Go-PPI伙伴蛋白与致癌突变具有重现性的相互作用(与3个或3个以上突变位点都有互作),这些蛋白富集在生长调控相关的通路,如细胞周期、PI3K/AKT/mTOR、JAK/STAT通路;而大部分(65%)的HS-Go-PPI伙伴蛋白只与1-2个突变位点有互作,说明这是突变导致的特异性改变。
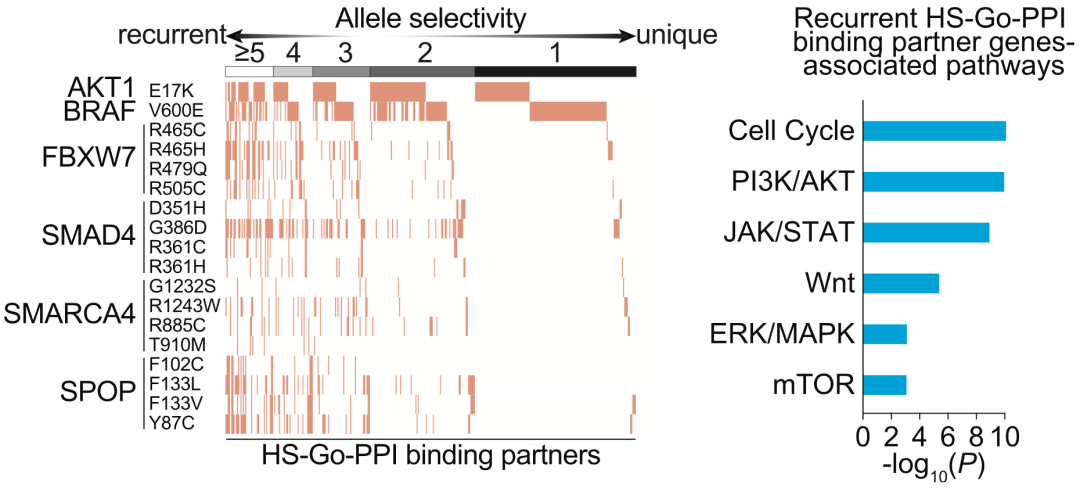
左. 聚类分析揭示了重现性和突变特异性Df-PPI伙伴蛋白;右. 重现性Df-PPI伙伴蛋白通路富集分析
尽管qHT-dS平台有高通量和定量化的优点,但因为利用了荧光标签和蛋白质过表达系统,对化学测量有一定影响,得到的结果可能不符合肿瘤细胞的实际情况。因此,有必要通过不使用荧光标签的蛋白互作试验对得到的HS-Df-PPIs进行验证。
研究者们通过GST pull-down、NanoPCA、semi-IP、co-IP等一系列互补的试验进行验证。以BRAFV600E突变为例,有六个HS-Go-PPIs得到四个试验同时支持,伙伴蛋白分别是BCL2L1、GSK3A、KEAP1、PDCD2L、POLE和VHL。这些蛋白互作成为候选neoPPIs,值得进一步进行功能实验。
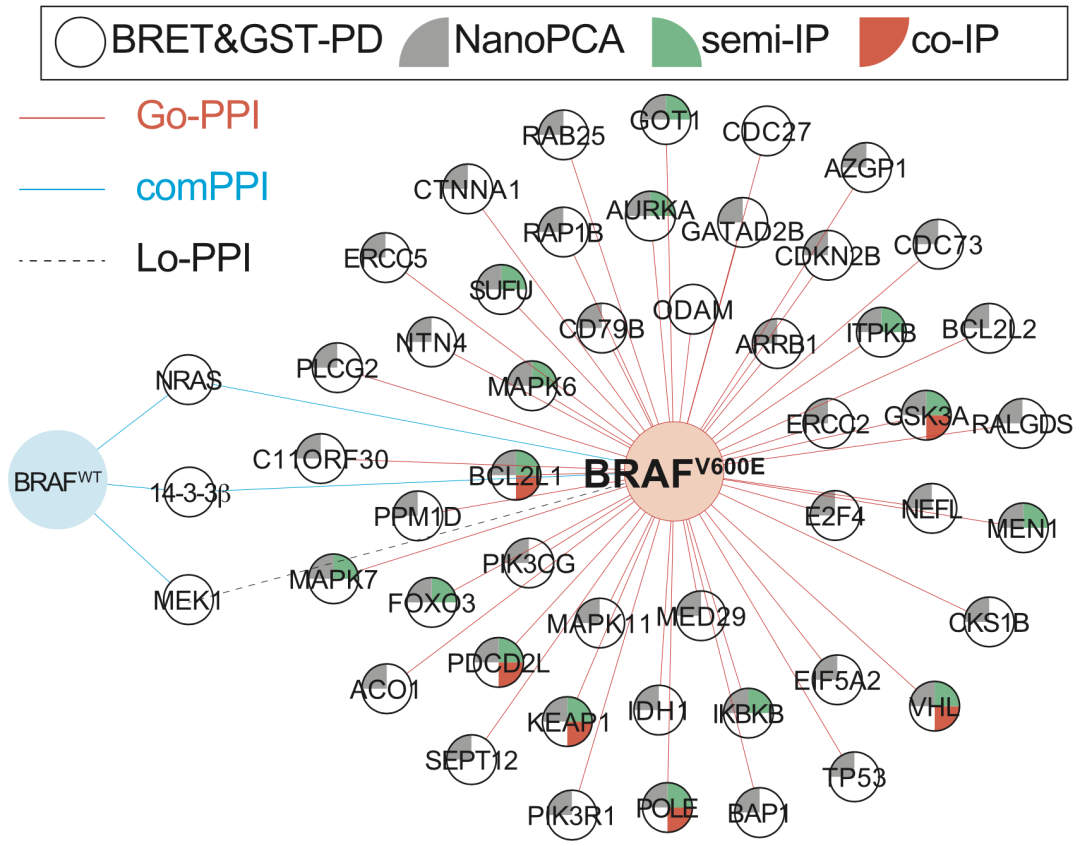
对BRAFV600E突变HS-Df-PPIs的蛋白互作正交实验验证结果
研究人员以BRAFV600E/KEAP1这对蛋白互作为例进行了功能研究,结果发现BRAFV600E通过增加与KEAP1的亲和力,与NRF2竞争结合KEAP1,从而释放NRF2的活性,并增加其下游NQO1的蛋白表达和活性。
NQO1是一种控制醌代谢的还原酶,能够解毒外源性醌化合物,清除细胞内的超氧化物,具有广泛的细胞保护作用[4]。NQO1在肿瘤细胞中常常过表达,并且与肿瘤转移和不良预后相关[5]。
研究者们检验了一种NQO1特异性的毒性底物DNQ对细胞生存的影响,结果发现携带BRAFV600E突变的细胞生长抑制比WT更明显。而在DNQ处理细胞后,再加用BRAF抑制剂vemurafenib,两药展现出明显的协同作用。
因此,BRAFV600E与KEAP1的neoPPI激活了NRF2介导的氧化还原途径,上调了NQO1表达,从而让肿瘤细胞对NQO1毒性底物更加敏感。新发现的NQO1毒性底物与vemurafenib的联合治疗策略值得进一步探索。
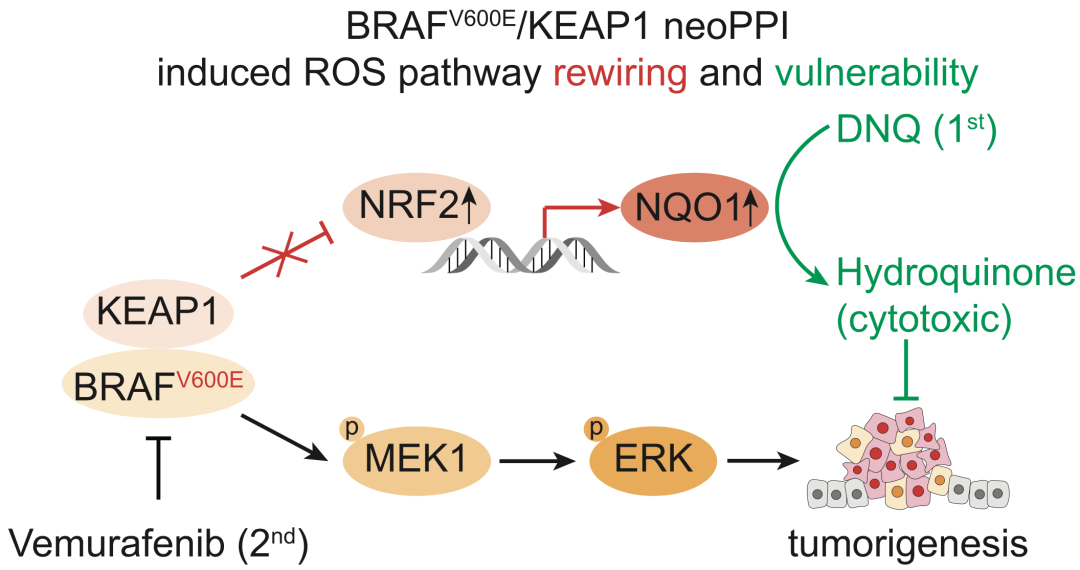
BRAFV600E/KEAP1 neoPPI重塑氧化还原途径的机制以及暴露的治疗靶点
总的来说,本研究开发了高通量、定量鉴定neoPPIs的技术平台,精准绘制了致癌突变位点导致的Df-PPIs图谱,揭示了基因突变引起neoPPIs的普遍性,以及同一基因不同突变位点所产生的neoPPIs的差异。
对BRAFV600E/KEAP1 neoPPI的功能研究发现了氧化还原通路的潜在治疗靶点NQO1。其他候选neoPPI值得未来进一步探索,将为开发突变位点导向的精准治疗策略提供极大帮助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


