Nature Medicine:基因疗法新时代,基因编辑如何改变视网膜疾病治疗格局?
来源:生物探索 2025-01-11 14:33
科学家开发了一种全新的双腺相关病毒(AAV)载体系统,将优化后的 ABE 递送至视网膜,成功实现了对 ABCA4 突变的高效修复。
视力是人类感知世界的主要途径之一,但各种视网膜疾病正威胁着数百万人的生活质量。在这些疾病中,Stargardt 病作为一种常见的单基因遗传性视网膜病变,对患者的中心视力造成了不可逆的破坏,严重影响了其阅读、驾驶及面部识别等能力。目前,这种疾病尚无有效治疗方法,而其主要病因源于 ABCA4 基因的双等位基因突变,尤其是 c.5882G>A 的点突变,这种突变导致视网膜内毒性维甲酸代谢产物的堆积,从而引发细胞死亡。随着精准医学的快速发展,基因编辑技术正逐步成为攻克遗传疾病的潜在利器。
近年来,碱基编辑(base editing)作为一种新兴的基因修复技术,展现了精准、高效的特点。特别是腺嘌呤碱基编辑器(adenine base editor, ABE),通过将腺嘌呤(A)精准地转换为鸟嘌呤(G),能够修复多种单碱基突变,而无需引发双链 DNA 断裂。尽管这种技术在体外和动物模型中已初见成效,但在复杂的人类神经组织,尤其是视网膜中的应用尚属首次。1月8日Nature的研究报道“High-efficiency base editing in the retina in primates and human tissues”,正是基于这一背景,开发了一种全新的双腺相关病毒(AAV)载体系统,将优化后的 ABE 递送至视网膜,成功实现了对 ABCA4 突变的高效修复。
研究结果表明,基因编辑器在携带突变的模型中实现了高达 75% 的视锥细胞(cones)和 87% 的视网膜色素上皮细胞(RPE)编辑率,而脱靶效应未见显著增加。这一突破性成果不仅为 Stargardt 病患者带来了治疗的曙光,也为其他与视网膜相关的遗传性疾病提供了广阔的应用前景。通过将先进的基因编辑技术与视网膜治疗结合,该研究为精准医学在眼科疾病中的转化奠定了基础,标志着视网膜疾病治疗进入了一个全新的时代。

突破视网膜疾病治疗的瓶颈
视网膜疾病是全球范围内导致失明的主要原因之一,对患者生活质量造成了深远影响。视网膜是眼睛感知光线的核心部位,其中包含用于高分辨率视力的黄斑区域,任何功能的损害都会直接影响患者的日常生活。例如,患者可能逐渐失去阅读、驾驶以及辨认面部的能力,而这种逐步恶化的过程往往是不可逆的。在众多视网膜疾病中,Stargardt 病因其高发病率和严峻的预后,成为了研究和治疗中的重要难题。
Stargardt 病是一种常见的单基因遗传病,每6500人中约有1人受其影响。这种疾病主要由 ABCA4 基因的功能缺失突变引起,尤其是 c.5882G>A 突变,它导致毒性视黄醛衍生物在视网膜色素上皮(RPE)细胞中堆积,最终引发视网膜细胞死亡。这种遗传病不仅对患者的中心视力造成严重影响,也对其心理健康与社会适应能力提出巨大挑战。然而,目前尚无能够有效阻止病情发展的疗法,这使得该领域亟需革命性技术的介入。
基因编辑技术的崛起,为遗传病的治疗带来了曙光。传统基因疗法虽取得一定进展,但多因脱靶效应、不完全修复等问题受限。而近年来发展出的碱基编辑技术,能够实现对单碱基突变的精准修复,成为治疗单基因疾病的潜在解决方案。
ABCA4基因与视网膜健康的奥秘
ABCA4基因是视网膜功能的关键基因之一,其编码的蛋白质是一种位于视网膜光感受器细胞中的膜脂转运蛋白。这种转运蛋白在清除视网膜中光感受器细胞代谢过程中产生的有毒视黄醛衍生物方面起着核心作用。通过及时转运并清除这些代谢产物,ABCA4蛋白可以有效防止毒性物质在光感受器细胞和视网膜色素上皮(RPE)细胞中的堆积,保护细胞免受损伤。正常情况下,ABCA4蛋白的功能对于维持视网膜光感受器的健康及视力的稳定至关重要。
然而,ABCA4基因的c.5882G>A突变改变了这一平衡。这一突变导致编码的蛋白功能丧失,使得有毒代谢产物无法被有效清除,从而在视网膜中积累。这种积累直接导致了光感受器细胞和RPE细胞的逐渐死亡,最终引发视网膜萎缩以及Stargardt病的典型症状,如黄斑区域的视力丧失及中心视野的渐进性模糊。研究显示,这一突变是Stargardt病中最常见的致病变异,影响约15%的患者,其显著的临床相关性使其成为重点研究和治疗的目标。
ABCA4被认为是治疗Stargardt病的核心靶点,不仅因为其功能丧失直接导致疾病发生,还因其单基因突变的特性使其成为基因编辑技术的理想候选。
腺嘌呤碱基编辑器(ABE):基因修复的利器
碱基编辑技术是一种革新的基因编辑方法,与传统的CRISPR-Cas9系统不同,它无需引发DNA双链断裂,而是通过精确的化学修饰将一种碱基直接转换为另一种碱基。在该研究中,研究人员利用腺嘌呤碱基编辑器(adenine base editor, ABE),实现了将腺嘌呤(A)转换为鸟嘌呤(G)的单碱基修复,从而有效纠正了ABCA4基因中的致病性c.5882G>A突变。这种技术不仅避免了双链断裂可能引发的细胞毒性,也显著提升了编辑的安全性和效率。
ABE的核心组成包括一个Cas9“切口酶”(nickase)和一个优化的tRNA腺苷脱氨酶(TadA),两者通过指导RNA(gRNA)精准定位到目标突变位点。在短暂的编辑窗口内,ABE将目标腺嘌呤脱氨化,生成鸟嘌呤,与之配对的胸腺嘧啶(T)则被逐步替换为胞嘧啶(C)。该研究通过优化gRNA设计,将突变位点精准定位在编辑窗口中,同时避免潜在的脱靶效应。通过体内和体外实验,研究人员确认,ABE在目标区域的编辑效率高达87%,而脱靶效应低至检测下限,展现了其精准性和安全性。
为了解决基因编辑工具在视网膜中递送的技术瓶颈,研究人员创新性地设计了一种双腺相关病毒(AAV)载体系统。由于ABE的编码序列超过了单个AAV的包装容量,研究团队采用了分体式载体,将ABE拆分为两个部分,通过“蛋白质自组装”恢复功能。这种设计大幅提高了ABE在视网膜细胞中的递送效率,使编辑工具能够有效作用于目标细胞,并实现基因修复。
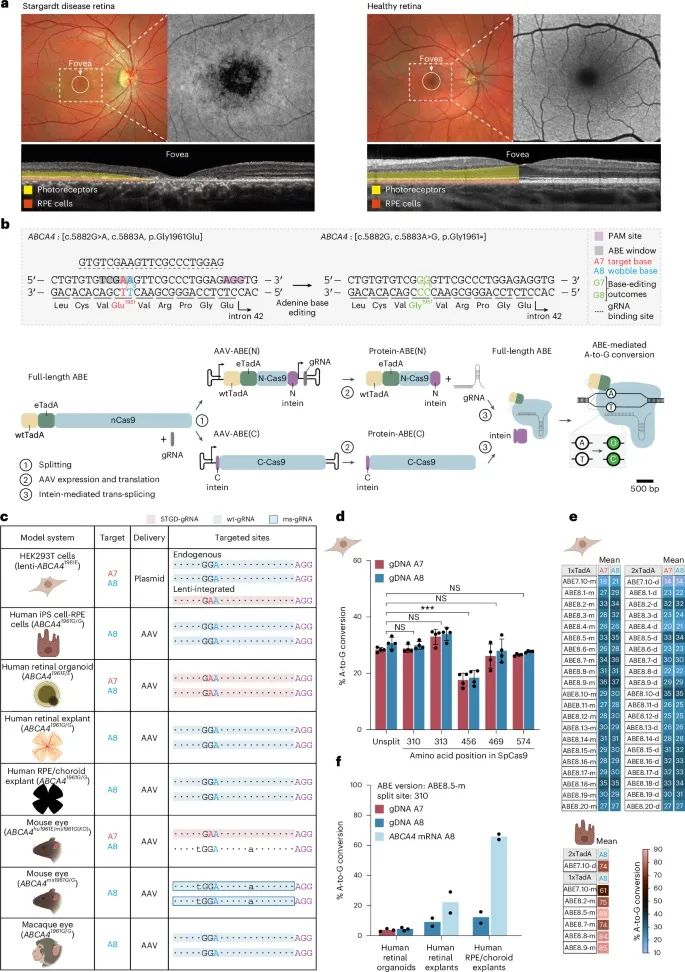
ABE在体外环境中修复Stargardt病相关基因突变的高效性和可行性(Credit: Nature Medicine)
患者视网膜与健康视网膜的对比(a)
图像显示了携带ABCA4基因双等位基因突变(c.5882G>A和c.66G>A)的Stargardt病患者与健康个体视网膜的差异。在患者视网膜中,黄斑中心区域的自发荧光信号显著降低,暗示视网膜色素上皮(RPE)细胞的萎缩。光学相干断层扫描(OCT)图像进一步展示了患者视网膜中光感受器和RPE层的明显变薄。
双AAV分体式腺嘌呤碱基编辑策略(b)
研究采用双AAV载体系统递送ABE,以修复c.5882G>A突变,同时针对c.5883A(同义突变)也产生编辑。图中解释了编辑窗口范围内的目标腺嘌呤位置,并描述了两种tRNA腺苷脱氨酶(WtTadA和eTadA)的作用机制。
模型系统的构建和编辑效率的评估(c)
图中列举了用于评估编辑效率的模型系统,包括视网膜光感受器和RPE细胞模型。表格详细说明了模型的基因型、目标腺嘌呤位置、递送方式以及特定的gRNA类型(如STGD-gRNA、wt-gRNA和ms-gRNA)。
不同分割位点和ABE版本的编辑效率(d和e)
d:在携带ABCA4突变的HEK293T细胞中,使用不同分割位点的ABE7.10,评估其对目标位点(A7和A8)的编辑效率。结果显示,编辑效率因分割位点的不同而异,未分割的ABE7.10表现最佳。
e:比较了多种ABE版本(包括ABE8.5)的编辑效率,并通过双AAV递送,在人类iPS细胞衍生的RPE细胞中观察到高效编辑。
ABE8.5m的多模型编辑结果(f)
在人类类器官和组织模型中,使用ABE8.5m分体式编辑器(分割点位于SpCas9的第310位氨基酸),通过双AAV递送实现了高效的基因组和mRNA水平编辑。数据显示,在不同模型中,编辑效率均达到显著水平,进一步验证了ABE的高效性和适用性。
实验验证:从细胞模型到动物体内的全方位探索
为了验证腺嘌呤碱基编辑器(ABE)在修复ABCA4基因突变中的有效性和安全性,研究团队开展了一系列从体外到体内的综合实验,涵盖了人类视网膜类器官、小鼠模型和非人灵长类动物,逐步推进基因编辑技术向临床应用的转化。
在体外实验中,研究人员利用人类诱导多能干细胞(iPS细胞)分化形成的视网膜色素上皮(RPE)细胞和视网膜类器官模型,模拟Stargardt病患者的视网膜环境。他们将ABE通过双AAV载体递送到这些模型中,成功实现了目标基因的高效修复。结果显示,ABCA4基因的编辑率在RPE细胞中达到66%,在视网膜类器官的光感受器细胞中达到22%。此外,实验还证明,ABE的脱靶效应在检测范围内未发现显著风险,为其临床安全性提供了重要证据。
在小鼠实验中,研究团队使用携带人类ABCA4突变的“人源化”小鼠模型,通过视网膜下腔注射递送ABE。他们观察到,在视网膜光感受器细胞和RPE细胞中,基因编辑效率分别达到了52%和79%。尽管如此,为进一步评估安全性,研究还在小鼠的中枢神经系统和外周器官中进行脱靶效应检测,结果未发现ABE的编辑作用扩散至视网膜外组织,验证了其局部性和安全性。
在非人灵长类动物(NHPs)中,实验进一步推进至临床相关的环境。通过对恒河猴的视网膜进行ABE递送,研究在视网膜光感受器细胞和RPE细胞中获得了高达40%的编辑效率,同时未发现显著的脱靶效应。作为哺乳动物中唯一拥有黄斑结构的动物模型,NHPs的实验结果表明,该技术具有良好的临床可行性,为后续临床试验奠定了坚实基础。
通过这一系列从细胞到动物的实验验证,研究团队不仅展示了ABE的强大修复能力,也为其安全性和临床转化提供了重要支持,标志着精准基因编辑技术向治疗遗传性视网膜疾病迈出了关键一步。
从数据看未来:基因编辑的潜力与局限
该研究中,腺嘌呤碱基编辑器(ABE)通过精准修复ABCA4基因的突变,在视网膜中实现了前所未有的高效修复率。实验显示,基因编辑效率在视锥细胞中高达75%,在视网膜色素上皮(RPE)细胞中达到87%。这样的高效性得益于双AAV载体系统的创新设计和ABE工具的优化。通过调整编辑器的分体位置和核定位信号(NLS),以及优化引导RNA(gRNA)以精准定位突变位点,研究团队最大限度地提升了ABE的活性。此外,他们采用强效启动子和多种优化的3'非翻译区(UTR)元件,如bGH polyA和WPRE,进一步增强了ABE的表达水平。这些改进共同作用,确保了编辑器在目标细胞中的高效发挥。
安全性始终是基因编辑技术走向临床的核心考量。该通过一系列严格的脱靶效应分析,验证了ABE的高精准性。在人类视网膜和RPE细胞的实验中,研究团队使用OligoNucleotide Enrichment and sequencing(ONE-seq)技术,系统筛查了潜在的脱靶位点,并结合深度测序分析了目标位点附近的碱基变化。结果显示,ABE在目标位点外未诱导显著的A-to-G转换,证明其编辑作用高度局限于设计区域。此外,实验还在小鼠和非人灵长类动物中确认,ABE的编辑效应严格局限于视网膜,未对其他组织或器官产生影响,进一步验证了其局部安全性。
这些数据背后的意义远超单一实验结果。ABE在视网膜中的高效修复,不仅为Stargardt病患者带来了治愈希望,也为精准医学打开了全新视野。当然,ABE在大规模临床应用前仍需解决剂量依赖性、安全性长期评估等问题。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


