Nature:利用改良版IL-2抑制Tr1细胞有望改善免疫疗法的抗癌能力
来源:生物谷原创 2024-08-19 11:21
在这项新的研究中,令研究者吃惊的是,旨在高度激活辅助性T细胞的疫苗却产生了相反的效果,抑制了肿瘤排斥反应。
通过调动免疫系统来对抗肿瘤细胞,免疫疗法提高了生存率,为数百万癌症患者带来了希望。然而,只有大约五分之一的人对这类疗法产生了良好的反应。
为了了解和解决免疫疗法的局限性,来自华盛顿大学医学院的研究人员发现,免疫系统在抗击癌症的过程中可能是自己最大的敌人。在一项对小鼠进行的新研究中,他们指出免疫细胞的一个亚群——1型调节性T细胞(type 1 regulatory T cell, Tr1细胞),在防止免疫系统过度反应方面发挥了正常作用,但却在无意中抑制了免疫疗法的抗癌能力。相关研究结果发表在2024年8月1日的Nature期刊上,论文标题为“Neoantigen-specific cytotoxic Tr1 CD4 T cells suppress cancer immunotherapy”。

论文通讯作者、华盛顿大学医学院病理学与免疫学系教授Robert D. Schreiber博士说,“Tr1细胞被发现是免疫疗法有效对抗癌症的一个前所未见的障碍。通过消除或规避小鼠体内的这一障碍,我们成功地重新激活了免疫系统的抗癌细胞,并为更多癌症患者发现了扩大免疫疗法益处的机会。”
癌症疫苗是个性化癌症免疫疗法的一种新方法。这类疫苗针对患者肿瘤特有的突变蛋白,诱导杀伤性T细胞攻击肿瘤细胞,而不伤害健康细胞。Schreiber团队之前的研究已表明更有效的疫苗还能激活辅助性T 细胞(另一种免疫细胞类型),从而招募和扩增更多的杀伤性 T 细胞来消灭肿瘤。但是,当他们尝试增加辅助性T 细胞靶点的数量以增强疫苗效果时,发现它们产生了一种不同类型的 T 细胞,这类T细胞会抑制而不是促进肿瘤排斥反应。
论文第一作者、华盛顿大学医学院病理学与免疫学讲师Hussein Sultan博士说,“我们测试了这样的一种假设:通过增加辅助性T细胞的活化,我们将诱导小鼠增强对肉瘤的清除。于是,他给各组携带肿瘤的小鼠注射了疫苗,这些疫苗能同样激活杀伤性 T 细胞,同时引发不同程度的辅助性 T 细胞激活。”
在这项新的研究中,令研究者吃惊的是,旨在高度激活辅助性T细胞的疫苗却产生了相反的效果,抑制了肿瘤排斥反应。
Sultan说,“我们原以为辅助性 T 细胞激活程度越高,就越能消除小鼠体内的肉瘤。相反,我们发现含有高剂量辅助性T细胞靶点的疫苗诱导了抑制性Tr1细胞,完全阻止了肿瘤的消除。我们知道Tr1 细胞通常会控制过度活跃的免疫系统,但这是第一次证实它们会抑制免疫系统与癌症的斗争。”
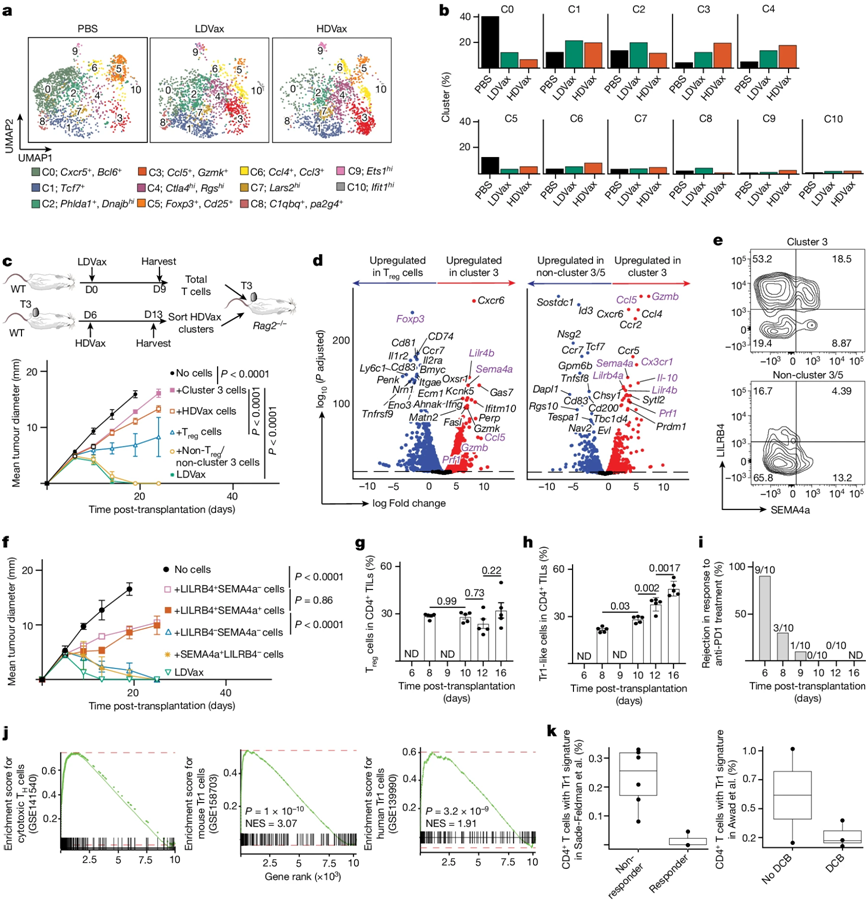
图片来自Nature, 2024, doi:10.1038/s41586-024-07752-y
Tr1 细胞通常会给免疫系统踩刹车,防止它攻击人体的健康细胞。但它们在癌症中的作用尚未得到认真研究。研究者翻阅了以前发表的数据,发现与免疫疗法反应良好的患者相比,免疫疗法反应不佳患者的肿瘤中含有更多的Tr1细胞。随着肿瘤变大,小鼠体内的Tr1细胞数量也在增加,导致小鼠对免疫疗法不敏感。
为了绕过这些抑制性的细胞,研究者用一种能增强杀伤性T细胞战斗力的药物治疗接种过疫苗的小鼠。这种药物由生物技术初创公司Asher Biotherapeutics开发,对白细胞介素2(IL-2)这一免疫增强蛋白进行了修饰,从而特异性增强了杀伤性T细胞的战斗力,并降低了未经修饰的IL-2疗法的毒性。该药物的额外促进作用克服了Tr1细胞的抑制作用,使免疫疗法更加有效。
Schreiber说,“我们致力于实现免疫疗法的个性化并扩大其疗效。数十年的肿瘤免疫学基础研究拓展了我们对如何触发免疫系统以实现最强有力的抗肿瘤反应的理解。这项新研究加深了我们对如何改进免疫疗法使更多人受益的理解。”
作为提供了小鼠版的改良IL-2药物的Asher Biotherapeutics公司的联合创始人,Schreiber间接参与了该公司旨在测试人类版IL-2药物作为癌症患者的单一疗法的临床试验。如果该临床试验取得成功,这种药物还有可能与癌症疫苗联合使用。(生物谷Bioon.com)
参考资料:
Hussein Sultan et al. Neoantigen-specific cytotoxic Tr1 CD4 T cells suppress cancer immunotherapy. Nature, 2024, doi:10.1038/s41586-024-07752-y.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


