Nat Methods:赵唯淞/李浩宇/陈良怡合作发明SN2N自启发去噪方法,实现快速、温和的长时程超分辨成像
来源:生物探索 2024-09-14 09:33
SN2N不仅打破了传统超分辨显微成像技术在光子效率和数据需求方面的瓶颈,还能应用到多种现有的超分辨显微镜系统。
活细胞超分辨荧光显微成像技术的发展目标是在生理友好的成像条件下保持足够的时空分辨率。然而,提升空间分辨率通常需要增加照明强度或延长曝光时间,同时还需匹配时间分辨率以防止运动伪影,因此活细胞超分辨成像中光子效率的提升至关重要。深度神经网络利用监督学习拟合噪声图像与干净图像之间的映射,能够显著提升光子效率,然而其需要收集大量配对的干净图像,难以应用于活细胞。另一方面,无监督学习去噪方法给超分辨成像提升光子效率提供了另一种选择【1-9】,但仍需要大量的噪声图像对进行学习,去噪效果有限且数据效率低。因此,如何能在有限的数据下、在无需噪声图像对条件下,开发无监督学习去噪方法提升超分辨显微系统光子效率,实现活细胞超分辨尺度下长时程成像目标,仍是目前领域内的挑战。
2024年9月11日,哈尔滨工业大学赵唯淞/李浩宇团队与北京大学赵士群/陈良怡团队合作在Nature Methods上在线发表论文Self-inspired learning for denoising live-cell super-resolution microscopy。他们提出一种基于无监督学习的自启发学习去噪方法(Self-inspired Noise2Noise, SN2N),首先利用超分辨系统的空间采样冗余特性设计自监督数据生成策略,从单张图像生成所需的噪声对图像作为数据集。同时开发自约束学习策略,进一步提高去噪性能和数据效率,仅使用单一噪声图像即可去噪,在无需大训练集和高信噪比真值图像的条件下,将光子效率提升了两个数量级,实现了在低光照条件下的温和、长时程活体成像。
该技术在转盘共焦超分辨显微系统上成功观察到了超过三小时的五维(xyz-颜色-时间)有丝分裂完整过程,分辨率达到90nm。此外,该技术具有广泛的适用性,能够应用于各种超分辨显微成像系统,包括结构光显微镜(SIM)、受激辐射损耗显微镜(STED)、膨胀显微镜(ExM)、荧光涨落超分辨成像(SOFI),甚至可以应用于双光子钙信号成像中,为在超分辨尺度下研究细胞器互作原理及其他生物医学研究提供了新的科学影像工具。

应用举例:四色活细胞超分辨成像
研究者将SN2N方法,结合RL(Richardson-Lucy)解卷积技术提高分辨率,开发RL-SN2N方法,并应用于基于转盘共聚焦超分辨显微系统(Spinning Disk Confocal Structured Illumination Microscopy, SD-SIM),实现了清晰的四色活细胞成像(视频1)。SN2N使得快速而复杂的细胞器动态过程得以可视化,研究者进一步对不同细胞器的轨迹和空间分布进行详细记录,追踪多个细胞器之间的相互作用事件,深入探索细胞器之间的协同作用和相互作用关系。
对比验证SN2N去噪优越性:四色活细胞超分辨成像
研究者还在上述SD-SIM四色活细胞成像数据上,将RL-SN2N与多种无监督去噪方法进行了对比,包括Noise2Void(N2V)【1】、 parametric probabilistic Noise2Void(PPN2V)【2】、Self2Self(S2S)【3】、Recorrupted2Recorrupted(R2R)【4】、Noise2Fast(N2F)【5】、DeepCAD【6】、DeepSeMi【7】和SRDTrans【8】。RL-SN2N能够清晰地解析亚细胞器尺度上不同细胞器的互作关系。相比之下,其他无监督去噪方法在这种超低信噪比条件下未能有效去除噪声,无法提供良好的数据去噪结果(图1)。这突显了RL-SN2N在极低信噪比成像数据处理中的显著优势。
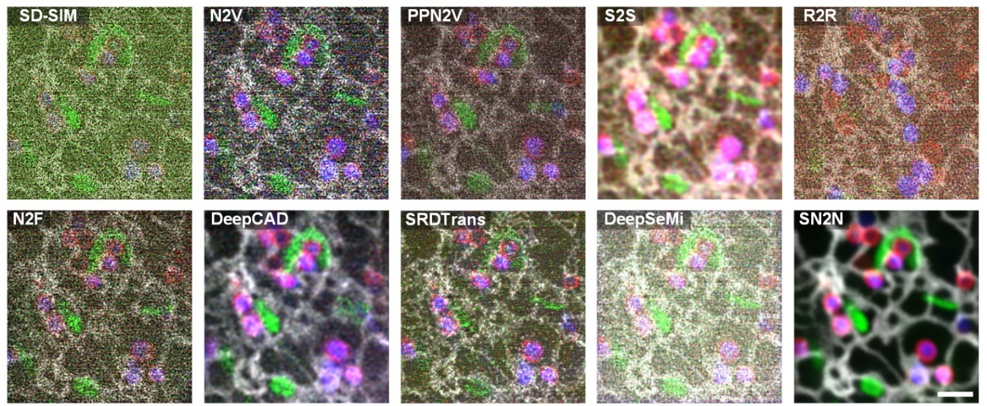
图1:SN2N在SD-SIM四色活细胞数据上与其他无监督去噪方法的去噪效果对比。比例尺:1 µm。(Credit: Nature Methods)
应用举例:活细胞五维长时程SD-SIM成像
应用举例:SN2N实现长时程活细胞STED成像
研究者还将RL-SN2N应用于商用STED系统(Abberior Instruments STEDYCON),在低光照和短像素持续时间条件下进行成像。在这一设置下,RL-SN2N成功捕捉到了在线粒体(PK Mito Orange标记【9】)融合和分裂过程中复杂的嵴运动(图2),记录时间长达半小时,展示了自启发去噪方法在减少光漂白和维持高时间分辨率方面的有效性。
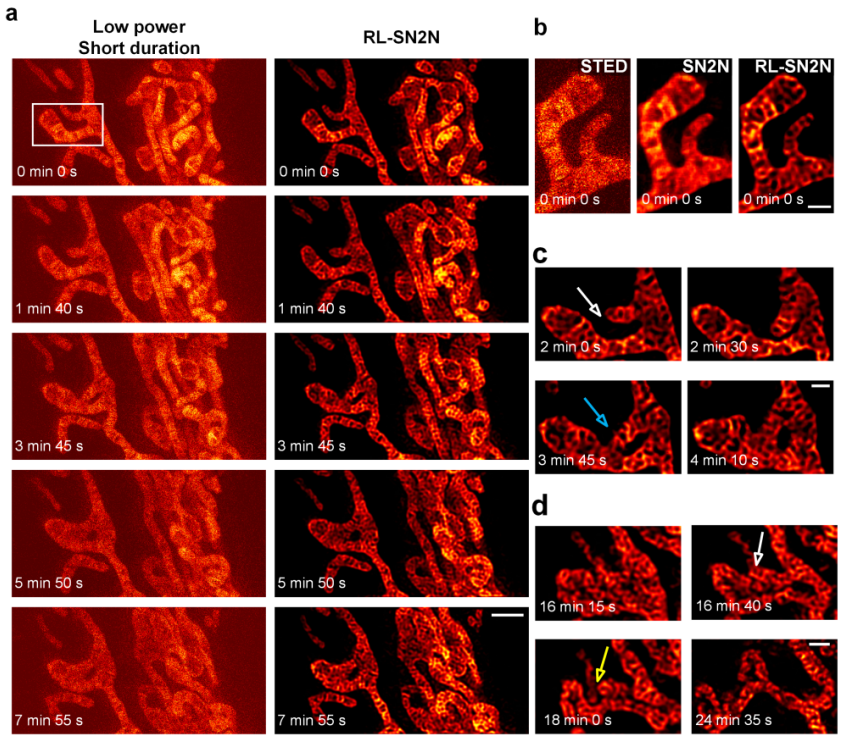
图2:SN2N允许长时程活细胞STED成像。a,低光照和短像素持续时间成像条件下的STED(左)和RL-SN2N(右)成像结果。b,a中白框区域的放大视图。c-d,线粒体融合(c)和分裂(d)的代表图像序列。黄色箭头和蓝色箭头分别标示线粒体融合和分裂的区域,白色箭头指示事件发生前的时刻。比例尺:500 nm(a-d)。(Credit: Nature Methods)
应用举例:SN2N提高SOFI重建效率
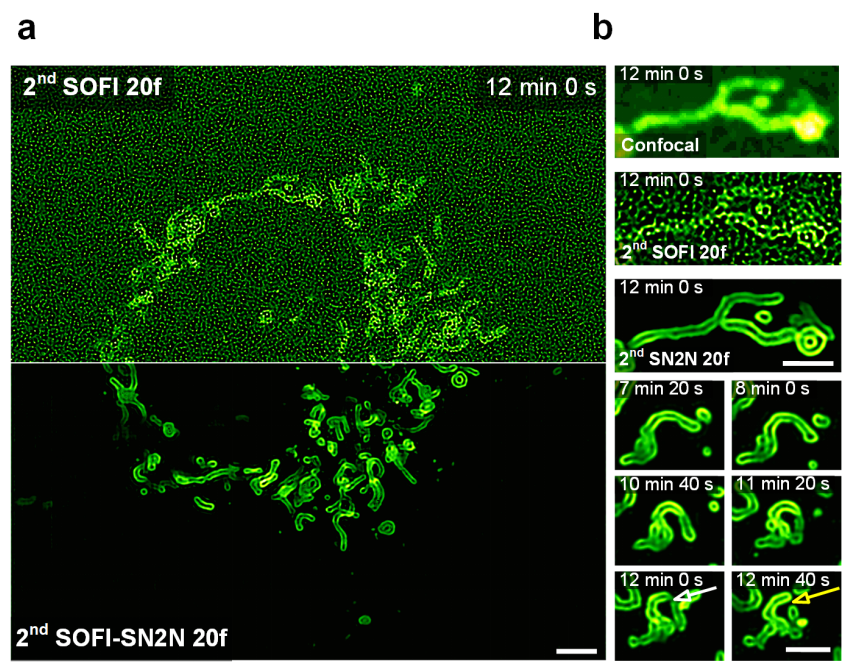
图3:SOFI-SN2N在活细胞中高效重建SOFI。a, 基于SD-confocal显微系统的COS-7活细胞SOFI-20f成像及其SN2N结果。b,线粒体外模结构的放大视图。前三行,从上到下依次为:SD-confocal图像、二阶SOFI 20f重建结果和二阶SOFI-SN2N 20f结果;后三行为一个代表性的线粒体分裂事件。黄色箭头和白色箭头分别指示了线粒体分裂和分裂前的状态。比例尺:2 µm(a, b)。(Credit: Nature Methods)
应用举例:双光子钙离子成像验证SN2N线性响应
针对钙离子成像这一具有时间冗余特性的数据,SN2N流程中也纳入了时间交错采样【6】策略(SN2N(temporal)),以在实现优异空间去噪效果的同时更好地维持时间信号稳定性。利用双光子显微镜数据对快速钙离子瞬变进行去噪,研究者验证了SN2N的线性响应。结果表明,SN2N在处理不同钙离子瞬变幅度时未出现非线性扰动,定量分析显示其去噪过程具有较高的准确性,具有更优的时空去噪能力(图4)。
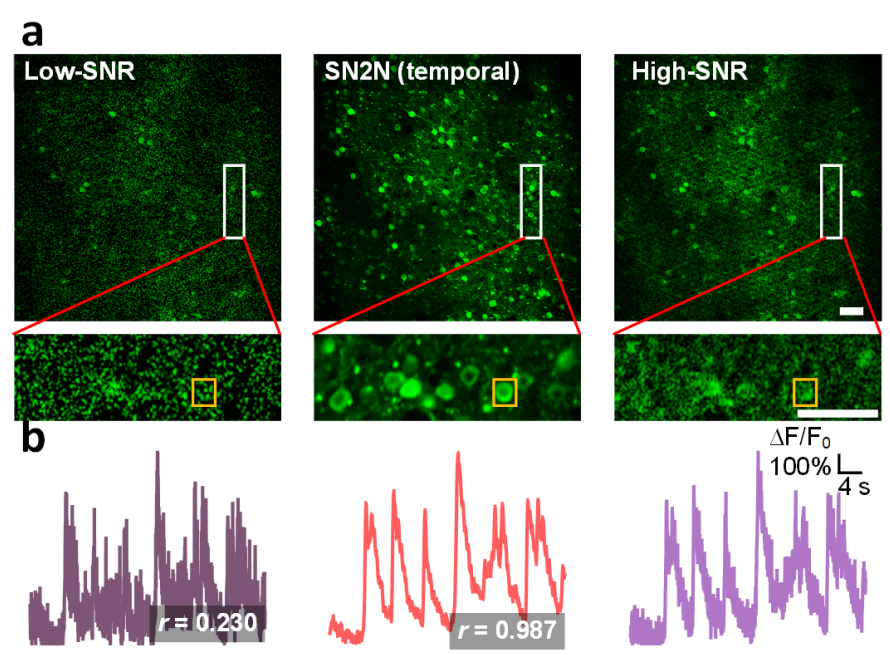
图4:使用双光子显微镜数据验证SN2N线性响应。a, 从左到右:低信噪比的双光子钙离子数据、SN2N(时间重采样)去噪结果,以及高信噪比双光子钙离子数据(十倍成像信噪比)。底行显示了白框区域的放大视图。b,从a中黄色框区域提取的沿时间轴的荧光轨迹曲线。轨迹的Pearson相关系数(r)标记在右下角。比例尺:50 µm(a)。(Credit: Nature Methods)
形象地说,SN2N技术就像一面神奇的镜子,通过自我反射和自我启发,将模糊的图像转化为清晰的图景,把那些难以辨识的生物信息逐渐呈现出来。它就像一位出色的解密者,能够将隐藏在迷雾中的生物世界的秘密一一揭示。SN2N巧妙地利用了超分辨率显微成像系统的物理特性,无需大量匹配图像的辅助,使得活细胞温和、长时程的超分辨成像成为现实。
参考文献:
1. Krull, A., Buchholz, T.-O. & Jug, F. Noise2void-learning denoising from single noisy images. Proceedings of the IEEE/CVF Conference on CVPR, 2129-2137 (2019).
2. Prakash, M., Lalit, M., Tomancak, P., Krul, A. & Jug, F. Fully unsupervised probabilistic Noise2Void. 2020 IEEE 17th International Symposium on Biomedical Imaging (ISBI), 154-158 (2020).
3. Quan, Y., Chen, M., Pang, T. & Ji, H. Self2self with dropout: Learning self-supervised denoising from single image. Proceedings of the IEEE/CVF Conference on CVPR, 1890-1898 (2020).
4. Pang, T., Zheng, H., Quan, Y. & Ji, H. Recorrupted-to-recorrupted: unsupervised deep learning for image denoising. Proceedings of the IEEE/CVF Conference on CVPR, 2043-2052 (2021).
5. Lequyer, J., Philip, R., Sharma, A., Hsu, W.-H. & Pelletier, L. A fast blind zero-shot denoiser. Nature Machine Intelligence 4, 953-963 (2022).
6. Li, X. et al. Reinforcing neuron extraction and spike inference in calcium imaging using deep self-supervised denoising. Nature Methods 18, 1395-1400 (2021).
7. Zhang, G. et al. Bio-friendly long-term subcellular dynamic recording by self-supervised image enhancement microscopy. Nature Methods 20, 1957–1970 (2023).
8. Li, X. et al. Spatial redundancy transformer for self-supervised fluorescence image denoising. Nature Computational Science 3, 1067–1080 (2023).
9. Liu, T. et al. Multi-color live-cell STED nanoscopy of mitochondria with a gentle inner membrane stain. Proc. Natl Acad. Sci. USA 119, e2215799119 (2022).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


