Cell Metab:张静等揭示内皮细胞在维持骨骼肌胰岛素敏感性中的关键作用
来源:生物探索 2024-09-14 10:52
该研究表明,内皮细胞通过创造免疫调节性微环境,控制驻留巨噬细胞的功能,在维持骨骼肌胰岛素敏感性方面起到关键作用。
骨骼肌是人体最大的器官,在维持全身葡萄糖代谢过程中发挥重要作用。研究发现,在静息状态下,混合餐中摄入的25-45%的葡萄糖被骨骼肌吸收【1】,而在高胰岛素性正糖钳夹 (hyperinsulinemic euglycemic clamped)条件下,这一比例可升高至85%【2】。血管内皮细胞 (EC)是血管的主要组成部分, 负责氧气, 葡萄糖及其它营养物质和代谢产物的输送。EC可以通过血管扩张或者是胰岛素运输来调控葡萄糖进入到骨骼肌中。但是葡萄糖如何通过血管进入到骨骼肌中尚未可知。
科学家们通过对葡萄糖转运蛋白亚型1(GLUT1)缺失病人的研究发现葡萄糖必须通过血脑屏障组成细胞- EC进入到脑脊液【3】。在骨骼肌中,葡萄糖似乎可以通过细胞间隙直接进入到骨骼肌组织间隙中【4】。然而,在肥胖小鼠模型中,EC-GLUT1的缺失导致骨骼肌组织中葡萄糖吸收下降。同时血管内皮细胞高表达GLUT1。这一发现促使我们进一步探讨内皮细胞GLUT1在维持骨骼肌稳态中的确切作用。
除了负责营养物质的运输,血管内皮细胞还可以通过在其微环境中产生和释放血管分泌因子(angiocrine factors)来调节组织稳态【5,6】。研究人员之前的研究发现血管内皮细胞通过代谢产物乳酸分泌可以调控骨髓来源巨噬细胞极化, 从而促进缺血后的支血管再生和肌肉组织再生【7】。然而,免疫调节信号也能对骨骼肌的葡萄糖稳态产生影响尚不清楚。
2024年9月12日,苏黎世联邦理工学院的Katrien De Bock团队(第一作者为张静)在Cell Metabolism杂志上发表了文章Endothelial metabolic control of insulin sensitivity through resident macrophages。

研究人员发现,内皮细胞GLUT1在稳态条件下调控骨骼肌和棕色脂肪组织的葡萄糖吸收,但不参与葡萄糖跨血管的运输。相反,它通过诱导骨骼肌胰岛素抵抗,降低组织对葡萄糖的吸收。骨骼肌的慢性炎症是胰岛素抵抗的主要原因。通过单细胞测序和流式分析,研究人员发现EC特异性GLUT1缺失在短时间内导致骨骼肌驻留巨噬细胞的堆积。骨骼肌中的巨噬细胞有两种来源:骨髓来源和胚胎来源。研究表明,骨髓来源的巨噬细胞是糖尿病和肥胖患者胰岛素抵抗的主要原因。然而,关于胚胎来源巨噬细胞在代谢稳态中的作用的研究较少。
研究人员发现,EC特异性GLUT1缺失主要导致胚胎来源巨噬细胞的增殖和堆积,而对骨髓来源巨噬细胞的影响较小。为了验证炎症性胚胎来源巨噬细胞堆积是否导致胰岛素抵抗,研究人员分别删除了EC特异性GLUT1缺失小鼠中的这两类巨噬细胞。结果表明,只有通过anti-CSF1R单抗删除胚胎来源的巨噬细胞才能缓解胰岛素抵抗。
为进一步研究内皮细胞是否通过血管分泌机制影响胚胎来源巨噬细胞的增殖,研究人员分离了GLUT1缺失的内皮细胞,并收集其条件培养基刺激骨髓来源巨噬细胞(BMDMs),发现GLUT1缺失的内皮细胞能促进BMDMs的增殖。进一步分析培养基和骨骼肌组织的分泌因子后发现,EC特异性GLUT1缺失导致骨桥蛋白(OPN)分泌增加。通过构建EC特异性Glut1/Spp1敲除小鼠,发现GLUT1缺失引发的胰岛素抵抗得到缓解。
进一步的研究显示,在短期高脂喂养条件下,大鼠的胰岛素抵抗并非由骨髓来源巨噬细胞堆积引起。通过对小鼠进行5天的高脂饮食喂养,研究人员发现EC中的GLUT1表达下降,同时OPN分泌增加,胚胎来源巨噬细胞的增殖上调。这一过程可能通过OPN受体Itga9介导,而非传统的CD44受体。
早期研究表明,OPN可以来源于多种细胞类型,其中髓系细胞是OPN的主要来源之一,也是慢性炎症的诱因之一。通过髓系特异性和EC特异性OPN缺失小鼠模型,研究人员发现髓系特异性OPN缺失虽会导致OPN下降,但对胚胎来源巨噬细胞无明显影响。而EC特异性OPN缺失不仅会导致OPN下降,还能抑制短期高脂刺激下胚胎来源巨噬细胞的增殖,从而缓解高脂饮食引发的胰岛素抵抗。
最后,通过对EC代谢组的检测,研究人员发现GLUT1缺失会导致内皮细胞的葡萄糖代谢重塑。内皮细胞通过降低其下游糖酵解以维持上游支路,如丝氨酸和核糖核苷酸合成的完整性。研究人员进一步筛选发现,培养基中增加丝氨酸和甘氨酸可以增强EC下游的糖酵解,并减少OPN的分泌。如果阻断丝氨酸参与神经酰胺合成的代谢途径,同样可以降低OPN的分泌,从而缓解GLUT1缺失引起的胰岛素抵抗。
综上所述,该研究表明,内皮细胞通过创造免疫调节性微环境,控制驻留巨噬细胞的功能,在维持骨骼肌胰岛素敏感性方面起到关键作用。
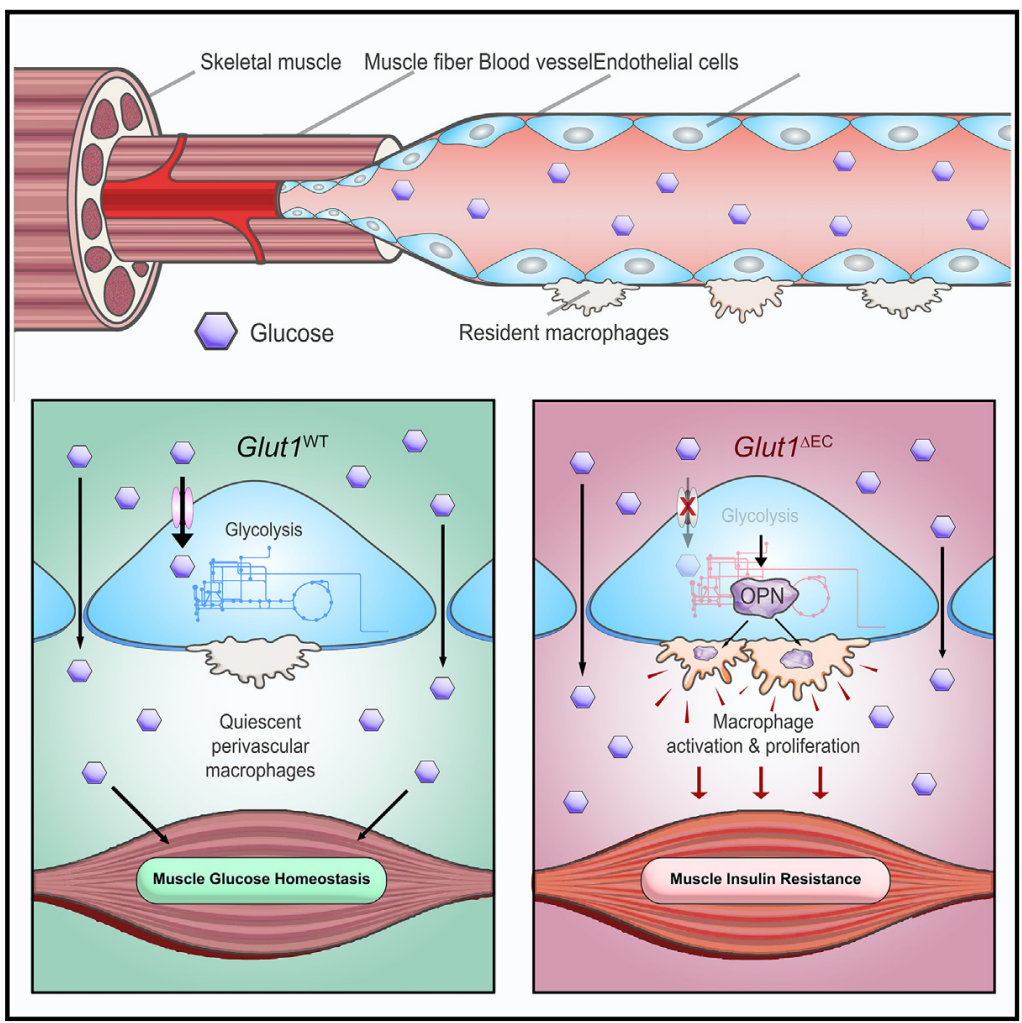
模式图(Credit: Cell Metabolism)
参考文献:
1 Kelley, D. et al. Skeletal muscle glycolysis, oxidation, and storage of an oral glucose load. J Clin Invest 81, 1563-1571 (1988). https://doi.org/10.1172/JCI113489
2 DeFronzo, R. A. et al. The effect of insulin on the disposal of intravenous glucose. Results from indirect calorimetry and hepatic and femoral venous catheterization. Diabetes 30, 1000-1007 (1981). https://doi.org/10.2337/diab.30.12.1000
3 De Vivo, D. C. et al. Defective glucose transport across the blood-brain barrier as a cause of persistent hypoglycorrhachia, seizures, and developmental delay. N Engl J Med 325, 703-709 (1991). https://doi.org/10.1056/NEJM199109053251006
4 Crone, C. & Thompson, A. M. Comparative studies of capillary permeability in brain and muscle. Acta Physiol Scand 87, 252-260 (1973). https://doi.org/10.1111/j.1748-1716.1973.tb05388.x
5 Augustin, H. G. & Koh, G. Y. Organotypic vasculature: From descriptive heterogeneity to functional pathophysiology. Science 357 (2017). https://doi.org/10.1126/science.aal2379
6 Rafii, S., Butler, J. M. & Ding, B. S. Angiocrine functions of organ-specific endothelial cells. Nature 529, 316-325 (2016). https://doi.org/10.1038/nature17040
7 Zhang, J. et al. Endothelial Lactate Controls Muscle Regeneration from Ischemia by Inducing M2-like Macrophage Polarization. Cell Metab 31, 1136-1153 e1137 (2020). https://doi.org/10.1016/j.cmet.2020.05.004
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


