Nature子刊:南京邮电大学汪联辉/丁显光团队开发效果更好的自体肿瘤疫苗
来源:生物世界 2024-10-02 12:34
该研究在微流控芯片上设计了一种适用于肿瘤来源的细胞外囊泡(TEV)的可逆免疫信号封装,使用5-10纳米厚的羟基氧化铁薄膜掩蔽TEV上的CD47信号,调控免疫细胞对TEV的识别。
南京邮电大学汪联辉、丁显光团队在 Nature 子刊 Nature Nanotechnology 上发表了题为:Non-discriminating engineered masking of immuno-evasive ligands on tumour-derived extracellular vesicles enhances tumour vaccination outcomes 的研究论文。
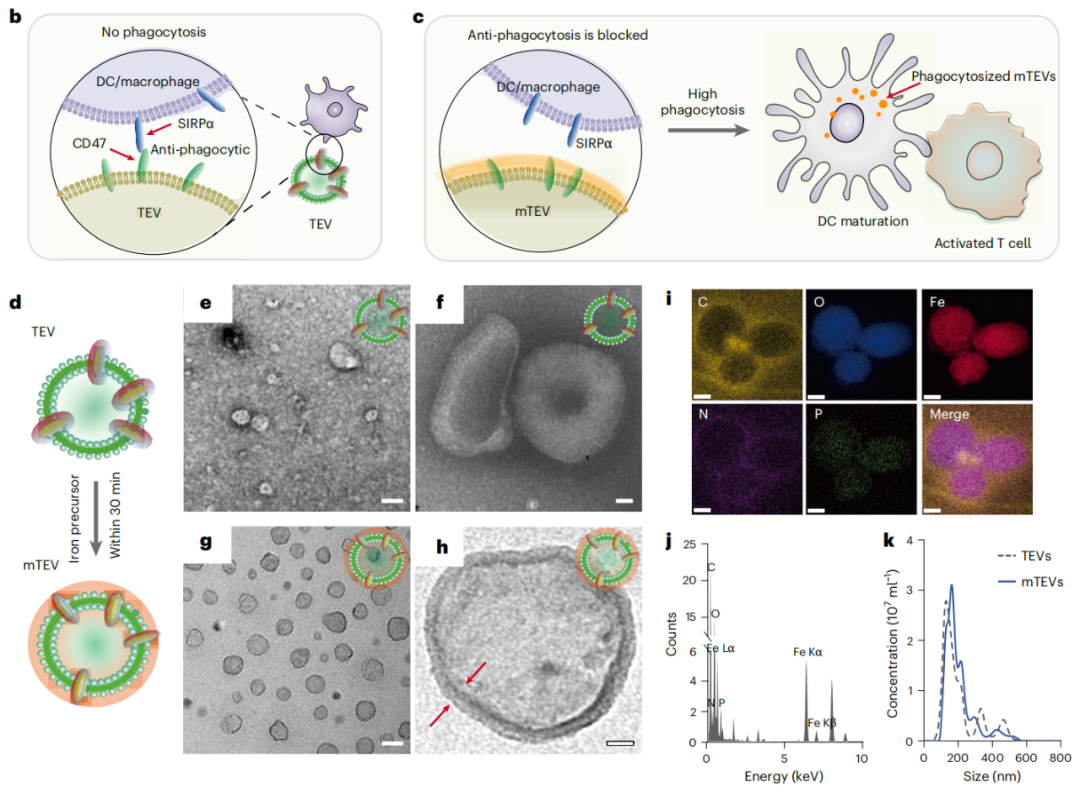
该研究在微流控芯片上设计了一种适用于肿瘤来源的细胞外囊泡(TEV)的可逆免疫信号封装,使用5-10纳米厚的羟基氧化铁薄膜掩蔽TEV上的CD47信号,调控免疫细胞对TEV的识别,提高免疫细胞对TEV的摄取和活化,进而增强对肿瘤的杀伤效果,并在人类恶性胸腹水模型中得到了初步验证。
在癌症患者中,固有免疫细胞(例如树突状细胞、巨噬细胞)会浸润肿瘤,并将肿瘤抗原加工和呈递给其他初始T细胞,然后这些初始T细胞攻击肿瘤细胞。这些免疫细胞使监控和训练免疫系统的关键的最初几个步骤成为可能,从而产生强大的抗癌效果。虽然树突状细胞和巨噬细胞可以在肿瘤本身的局部微环境中被发现,但它们最终需要吞噬肿瘤细胞产生的TEV来在正常健康细胞中准确识别出肿瘤细胞。如果没有TEV的吞噬作用,肿瘤抗原分子将无法被免疫细胞加工处理。
肿瘤细胞已经发展出了规避免疫检测和杀伤的机制,同时通过呈递抗吞噬抗原来实现促转移,例如在囊泡表面广泛存在的CD47。使用CD47抗体来阻断CD47介导的TEV的抗吞噬作用并不可信,因为这也会阻断全身正常细胞的抗吞噬作用,并可能激活固有免疫系统,使其转而攻击宿主的正常细胞。
为了克服这些问题,研究团队提出在体外将约5-10纳米厚的羟基氧化铁薄膜通过非常温和的表面反应覆盖在分离的TEV表面,形成了mTEV,以掩蔽CD47信号。这种薄膜的厚度是特意设计的,以掩盖在细胞外囊泡表面发现的CD47配体和其他未知转移标志物以及促肿瘤标志物。
通过这种方式掩蔽了抗吞噬信号后,可以刺激和启动固有免疫系统。由于无法确保机体的固有免疫系统能够捕获每一个mTEV,因此可能有一些mTEV从肿瘤微环境(TME)逃逸,并向潜在的转移部位移动。但由于促转移配体被掩蔽,因此它们的促转移功能再次被抑制。
具体来说,研究团队展示了羟基氧化铁纳米复合物可以成功掩盖TEV表面,解除吞噬细胞对它的吞噬障碍,而不影响TEV诱导的免疫目标。在TEV内化之后,羟基氧化铁纳米复合物在溶酶体中分解,释放出TEV中的肿瘤抗原货物。进而引发抗原呈递,促进树突状细胞激活和成熟,以及巨噬细胞重编程。在动物模型和人类恶性胸腹水临床样本中导致肿瘤体积和转移的显著减少。这种简单的掩蔽策略可以消除临床样本中普遍存在的抗吞噬作用,并可广泛应用于所有患者特异性TEV,作为增强免疫治疗的肿瘤抗原制剂。该技术绕过了了解每个细胞外囊泡上配体类型亚群身份的需要,因为超薄膜不具区分性且具有普遍性。这种逻辑解决了实际患者来源材料中众多独特未知因素的问题。
研究团队表示,该技术的特点和优势包括:1)基于患者自身的TEV,特别适用于晚期合并恶性胸腹水的肿瘤患者,能够通过化学改造构建特异性强的自体肿瘤疫苗(2)与使用抗体等阻断膜蛋白信号的传统生物学方法相比,可逆化学封装更具有成本效益,操作简便,且易于后续功能性改造;3)微流控芯片平台效率高,适合大规模生产,为开发基于改性囊泡的临床转化和满足GMP标准的囊泡药物批量生产打下基础。未来通过集成囊泡生成和分离模块,有望实现“样品进,疫苗出”的自动化生产平台。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


