盘点:2022年4月非编码RNA研究领域新进展
来源:生物谷原创 2022-04-29 16:45
2022年4月份非编码RNA相关发表了很多重磅级的研究成果,本文中,小编就对本月科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
2022年4月份非编码RNA相关发表了很多重磅级的研究成果,本文中,小编就对本月科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
【1】 针对SARS-CoV-2和新变种的环状RNA疫苗
DOI:10.1016/j.cell.2022.03.044
随着新出现的SARS-CoV-2变体继续推动全球大流行,对提供更有效和广谱保护的疫苗的需求不断增加。在本研究中,研究者报道了一种环状RNA (circRNA)疫苗,该疫苗通过表达刺突蛋白的三聚体RBD引发了强大的中和抗体和T细胞反应,在小鼠和恒河猴中对SARS-CoV-2提供了强大的保护。值得注意的是,与1mΨ-modified mRNA疫苗相比,circRNA疫苗能够产生更高、更持久的抗原,并引发更高比例的中和抗体和明显的th1倾斜免疫反应。重要的是,研究者发现circRNA疫苗诱导了对Omicron有效的中和抗体,但对Delta变种无效。相比之下,circRNA疫苗对Delta和Omicron都有保护作用,或在接种两剂本地或Delta特异性疫苗后发挥加强剂的作用,使其成为对抗当前令人担忧的SARS-CoV-2变种(VOCs)的有利选择。
【2】靶向非编码RNA克服癌症治疗耐药性
DOI:10.1016/j.cell.2022.03.044
现在众所周知,非编码RNA (ncRNAs),而不是蛋白质编码转录本,是优势RNA转录本。NcRNAs,尤其是microRNAs (miRNAs)、长链非编码rna (lncRNAs)和环状rna (circRNAs),被广泛认为是多种癌症特征的普遍调控因子,如增殖、凋亡、侵袭、转移和基因组不稳定性。尽管最近在癌症治疗方面有所发现,但对化疗、放疗、靶向治疗和免疫治疗的耐药性仍然是一个重大挫折。最近的研究表明,ncRNAs也在不同癌症治疗的耐药性中发挥重要作用,通过重组重要的信号通路。在这篇综述中,研究者介绍了失调的ncRNAs控制四种主要癌症治疗耐药性的复杂机制。研究者重点关注ncRNAs作为生物标志物的当前临床意义,以预测治疗反应(内在耐药性)和检测治疗开始后的耐药性(获得性耐药性)。此外,研究者将介绍靶向ncRNA克服癌症治疗耐药性的潜力,并将讨论靶向ncRNA治疗的挑战,特别是给药系统的开发。
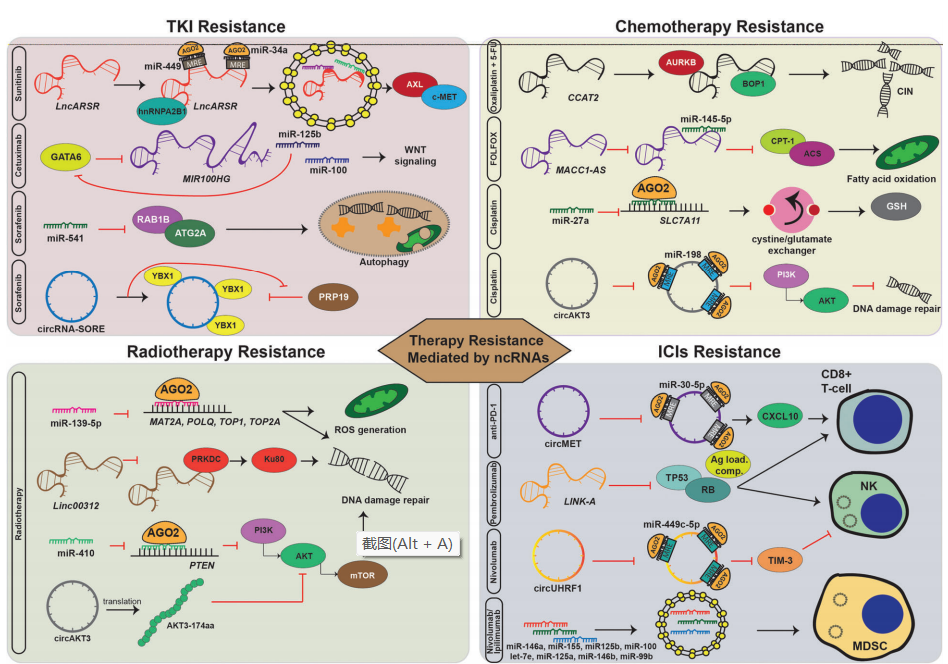
ncRNA介导的耐药机制
图片来源: https://doi.org/10.1038/s41392-022-00975-3
【3】圆形RNA翻译:新的蛋白质异构体和临床意义
DOI:10.1016/j.molmed.2022.03.003
近年来,环状RNA (circRNA)翻译的研究备受关注,以确定其临床意义。由内部核糖体进入位点(IRES)或含n6 -甲基腺苷(mA)的短序列驱动的环状RNA的帽独立翻译不同于线性mRNA的典型帽依赖翻译。可翻译的环状RNA可以产生具有新的生理作用的新的蛋白质或异构体。本文综述了参与环状RNA翻译的元素,以及翻译后的新蛋白亚型在人类疾病中的功能。本文还讨论了可翻译环状RNA和被翻译蛋白的双功能特性。此外,还提出了可以作为适当治疗选择的各种分子策略。
【4】n6 -甲基腺苷修饰的circMAP3K4编码的一种新型肽,可阻止肝细胞癌的凋亡
DOI:10.1186/s12943-022-01537-5
环状RNA (circRNAs)调节各种生物活性,并已被证明在肝细胞癌(HCC)的进展中发挥关键作用。然而,只有少数编码环状RNA在癌症中被发现,它们在HCC中的作用仍不清楚。本研究旨在识别编码环状rna并探讨其在HCC中的功能。CircMAP3K4是从CIRCpedia数据库中选择的。研究者通过一系列实验确定了circMAP3K4的特性和编码容量。然后,研究者利用体内和体外实验研究了circMAP3K4及其蛋白产物circMAP3K4-455aa在HCC中的生物学功能和机制。研究者发现circMAP3K4在HCC中是一种上调的circRNA,具有编码潜能。IGF2BP1识别了circMAP3K4 n6 -甲基腺苷修饰并促进其翻译到circMAP3K4-455aa。在功能上,circMAP3K4-455aa通过与AIF相互作用阻止顺铂诱导的肝癌细胞凋亡,从而保护AIF不被切割,减少其核分布。此外,circMAP3K4-455aa通过泛素-蛋白酶体E3连接酶MIB1途径降解。临床上,高水平的circMAP3K4是HCC患者不良总生存期和不良无病生存期的独立预后因素。CircMAP3K4是HCC中高表达的circRNA。在m6A修饰的驱动下,circMAP3K4编码circMAP3K4-455aa,保护肝癌细胞免受顺铂暴露,并预测肝癌患者预后恶化。靶向circMAP3K4-455aa可能为肝癌患者特别是化疗耐药患者提供一种新的治疗策略。CircMAP3K4是HCC中高表达的circRNA。IGF2BP1在m6A修饰的驱动下,促进circMAP3K4肽的翻译,circMAP3K4肽抑制AIF的切割和核分布,防止肝癌细胞在应激下的细胞死亡,促进肝癌的进展。
【5】环状RNA MTCL1通过抑制C1QBP泛素降解和介导-连环蛋白激活促进晚期喉部鳞状细胞癌进展
DOI:10.1186/s12943-022-01570-4
环状RNA (Circular RNAs, circRNAs)在转录后表观遗传修饰水平参与多种肿瘤中泛素化和去泛素化的调控过程。然而,环状RNA在晚期喉鳞状细胞癌(LSCC)中的潜在机制及其生物学功能尚不清楚。在本研究中,研究者应用RNA测序和实时荧光定量PCR (qRT-PCR)检测在LSCC组织和细胞系中差异表达的环状RNA。采用RNA下拉和质谱、原位杂交(ISH)、免疫组化(IHC)、qRT-PCR、生物信息学分析等方法检测候选RNA结合蛋白和靶信号通路。通过体外和体内实验,包括EdU、transwell、伤口愈合、western blot检测和异种移植小鼠模型,研究了这些分子的功能作用。通过RNA下拉实验、RNA免疫沉淀(RIP)、Co-IP、ISH、泛素化实验、生物信息学分析和救援实验确定其分子机制。在这里,研究者揭示了微管交联因子1 circRNA (circMTCL1, circ0000825)通过促进补体c1q结合蛋白(C1QBP)依赖的泛素降解并随后激活Wnt/β-catenin信号通路在喉癌发生和发展中发挥其关键的致癌功能。特别是,circMTCL1在LSCC患者配对组织中显著上调(n = 67),预测较差的临床结局。在功能上,circMTCL1通过促进细胞增殖能力和侵袭迁移能力发挥致瘤生物学特性。异位circMTCL1可增强LSCC细胞的增殖、迁移和侵袭能力,在体内外敲除C1QBP可逆转这种作用。在机制上,circMTCL1通过携带特异性识别序列(+ 159 - + 210)直接招募C1QBP蛋白,从而抑制C1QBP泛素-蛋白酶体介导的降解,从而加速C1QBP的翻译表达。重要的是,C1QBP与β-catenin蛋白的直接相互作用是通过抑制β-catenin磷酸化并加速其在细胞质和细胞核中的积累而增强的。该研究结果揭示了一个新的circMTCL1-C1QBP-β-catenin信号轴参与了LSCC的发生和发展,为circrnas -泛酸糖蛋白介导的泛素降解提供了新的思路,并为LSCC的治疗干预提供了策略和靶点。
【6】LINC01431通过稳定PRMT1,促进组蛋白H4R3甲基化,阻碍HBV共价闭合循环DNA转录
DOI:10.1002/advs.202103135
共价闭合环状DNA (Covalently closed circular DNA, cccDNA)是乙型肝炎病毒(HBV)的转录模板,它与宿主和病毒蛋白相互作用,在细胞核内形成小染色体,对抗病毒药物具有耐药性。识别参与cccDNA转录调控的宿主因子有望证明HBV治疗的一个新领域。最近的证据表明,长链非编码rna (long non - coding RNAs, lncRNAs)参与介导宿主因子与各种病毒的相互作用,然而,HBV靶向和抑制cccDNA转录的lncRNAs尚未完全阐明。在这里,作者发现LINC01431是一个新的HBV转录的宿主限制因子。机制方面,LINC01431与I型蛋白精氨酸甲基转移酶(PRMT1)竞争性结合,阻断hbx介导的PRMT1泛素化和降解。因此,LINC01431增加了cccDNA上PRMT1的占用,导致H4R3me2a修饰增强,cccDNA结合的组蛋白乙酰化降低,从而抑制cccDNA的转录。反过来,为了促进病毒复制,HBV通过hbx介导的抑制转录因子Zinc fingers和homeoboxes 2 (ZHX2)转录抑制LINC01431的表达。总之,该研究证明了LINC01431是cccDNA小染色体的一种新的表观遗传调控因子,并突出了HBx-LINC01431-PRMT1在HBV复制中的反馈回路,为HBV治疗提供了潜在的治疗靶点。
【7】狼疮增强因子风险变异通过lncRNA和DNA甲基化机制引起IRF8的失调。
DOI:10.1038/s41467-022-29514-y
尽管有强有力的证据表明,人类遗传变异影响与自身免疫性疾病相关的许多关键转录因子的表达,但在非编码风险变异及其调控的基因靶点之间建立生物学联系仍然是一个相当大的挑战。在本研究中,研究者结合遗传学、表观基因组学和CRISPR激活方法来筛选调控IRF8表达的功能性变异。研究者证明了含有rs2280381的基因座是一个细胞特异性的IRF8增强子,它与IRF8启动子在空间上相互作用。此外,rs2280381通过增强子RNA AC092723.1介导IRF8的表达,该增强子RNA将TET1招募到IRF8启动子,通过影响甲基化水平调控IRF8的表达。rs2280381等位基因调节PU.1结合和染色质状态,差异调控AC092723.1和IRF8的表达。该研究工作阐明了一种整合策略,以定义在自身免疫性疾病中调节关键基因表达的功能性遗传变异,并破译狼疮风险变异介导的IRF8表达失调的机制。
【8】TNF-α刺激可通过MEG3/miR-21a-5p轴增强牙龈MSCs来源的外泌体在视网膜缺血-再灌注损伤中的神经保护作用
DOI:10.1016/j.biomaterials.2022.121484
视网膜缺血-再灌注损伤(IRI)是青光眼的主要发病机制之一,其病理过程中包括神经炎症和神经元死亡等机制尚不清楚。在研究者之前的研究中,间充质干细胞(MSCs)已被报道具有抗炎和神经保护作用。此外,TNF-α刺激的MSCs条件培养液(CM)在实验性变应性结膜炎小鼠模型中具有更好的抗过敏作用。然而,迫切需要无细胞治疗方法,如外泌体,以减少自身免疫的副作用。本研究旨在阐明TNF-α刺激的牙龈间充质干细胞(GMSC)外泌体(TG-exos)在调节炎性小胶质细胞和减轻凋亡中的通路。在本研究中,利用超离心法从GMSCs的CM中分离出外泌体,并将其注射到小鼠的玻璃体中。结果表明,眼内注射TG-exos比G-exos (gmsc -外泌体)能显著降低IRI小鼠的炎症反应和细胞损失。在体外也观察到了类似的结果。此外,通过microRNA (miR)阵列,研究者发现miR-21-5p在TG-exos中发挥着神经保护和抗炎的关键作用。靶向预测和双荧光素酶实验表明,miR-21-5p通过结合程序性细胞死亡4 (PDCD4)发挥作用,而程序性细胞死亡4是由长链非编码RNA (lncRNA)母系表达基因3 (MEG3)作为竞争性内源性RNA (ceRNA)调控的。本研究通过MEG3/miR-21-5p/PDCD4轴传递富含miR-21-5p的外泌体,展示了一种新的神经保护IRI的治疗途径,并为建立一种无细胞治疗青光眼的方法铺平了道路。

TG-外泌体通过MEG3/miR-21-5p/PDCD4通路在视网膜IRI中的作用示意图
图片来源: https://doi.org/10.1016/j.biomaterials.2022.121484
【9】lncSLCO1C1在胃癌进展及奥沙利铂耐药中的作用
DOI: 10.1002/ctm2.691
胃癌是肿瘤转移和治疗耐药性最严重的疾病之一。了解肿瘤进展和耐药的分子机制将提高治疗效果,并开发新的干预策略。临床标本中差异表达的长链非编码rna (LncRNA)通过LncRNA芯片进行鉴定,并通过实时定量聚合酶链反应(qRT-PCR)、原位杂交和生物信息学分析在不同的临床队列中进行验证。通过细胞增殖实验、迁移实验、异种移植瘤模型和生物信息学分析研究lncRNA的生物学功能。采用彗星实验和免疫荧光实验评估lncSLCO1C1对GC细胞存活的影响。通过使用一些技术,包括RNA下拉、质谱分析、RNA免疫共沉淀、免疫共沉淀、miRNA测序、荧光素酶报告基因测定和分子模型,进一步探讨了潜在的分子机制。LncSLCO1C1在GC组织样本中高度上调,与GC患者较差的总生存期相关。过表达lncSLCO1C1可促进细胞增殖和迁移,而低表达lncSLCO1C1则相反。lncSLCO1C1也通过减少DNA损伤和增加细胞增殖来介导肿瘤对奥沙利铂化疗的耐药性。尽管lncSLCO1C1与PDE3A序列存在重叠,但PDE3A表达的改变对GC细胞的进展无影响,说明lncSLCO1C1而不是PDE3A与GC细胞的进展有关。机制上,lncSLCO1C1作为结构特异性识别蛋白1 (structure-specific recognition protein 1, SSRP1)/H2A/H2B复合体的支架,调节SSRP1降低DNA损伤的功能。同时,lncSLCO1C1可以像海绵一样吸附靶向SSRP1 mRNA的miR-204-5p和miR-211-5p,从而提高SSRP1的表达。lncSLCO1C1和SSRP1均高表达的患者总生存期较差,突显了lncSLCO1C1在GC进展中的作用。LncSLCO1C1通过相互作用和支撑SSRP1/H2A/H2b复合体并吸收miR-211-5p和miR-204-5p来增加SSRP1的表达,从而促进细胞生长和防止DNA损伤,从而促进GC进程。
【10】顺式调控lincRNA-p21的功能元件
DOI: 10.1016/j.celrep.2022.110687
p53诱导的长链非编码RNA (lncRNA) lincRNA-p21被认为在顺式中起作用,促进邻近细胞周期基因Cdkn1a/p21 p53依赖的表达。转录的lincRNA-p21调控位点激活p21表达的分子机制尚不清楚。为了阐明顺式调控的功能元件,研究者建立了一系列基因模型,这些模型可以破坏DNA调控元件、lincRNA-p21的转录或成熟lincRNA-p21的积累。出乎意料的是,研究者确定了全长转录、剪接和lincRNA-p21的积累对于基因座的染色质组织和顺式调控是可有可无的。相反,研究者发现通过lincRNA-p21外显子1的保守区域产生的lincRNA-p21促进顺式激活。这些发现表明,该lncRNA位点的初始转录被激活,而不是成熟lncRNA转录本的生成或积累,是调控局部基因表达的必要条件。
生物谷2022年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


