《自然评论》重磅综述:一文读懂胃癌治疗现在和未来!
来源:奇点糕 2023-01-03 11:10
胃癌和胃食管连接癌,一直都是癌症“杀手榜”上排名靠前的凶徒,据世卫组织2020年版全球癌症统计报告(GLOBOCAN)估算,全球每年新发胃癌达到108.9万例
胃癌和胃食管连接癌,一直都是癌症“杀手榜”上排名靠前的凶徒,据世卫组织2020年版全球癌症统计报告(GLOBOCAN)估算,全球每年新发胃癌达到108.9万例,因胃癌死亡76.9万人,两项数字分别在癌症中排名第五和第四。
而东亚的我国、日本和韩国,还是世界级的胃癌高发国家,奇点糕估计很多人都听过身边有人被胃癌夺命,所以这些年来,奇点糕也是对胃癌的治疗发展动向格外关注,但值得高兴的好消息,实在还是太少了。
尤其是对“铜豌豆”一般难治的晚期胃癌,这些年来取得一定战果的,也就是抗HER2的单抗类靶向药和免疫治疗,但临床获益也比较有限。所以是时候从原点出发,回顾一下胃癌治疗这些年来的发展之路,总结总结经验教训了。
近期在《自然评论·胃肠病学和肝病学》(Nature Reviews Gastroenterology & Hepatology)期刊上,三位西班牙学者就发文全面盘点了胃癌的分子分型、现有精准治疗药物,以及领域内大量的II/III期临床研究探索[1],很值得一看哦。

论文首页截图
胃癌特点简述
根据胃癌的发病部位,可以将胃癌分为贲门癌和非贲门癌,两类胃癌在发病危险因素上存在差异:贲门癌可能呈“双重病因”,即幽门螺杆菌(Hp)感染和肥胖、胃食管反流病等因素同时参与,在病因学上类似胃食管连接癌;而发生于胃下部的非贲门癌,往往与Hp感染、吸烟、饮酒、高盐饮食等多种危险因素有关。
从流行病学变化趋势来看,近年来非贲门癌的发病率在一些国家呈下降趋势,这可能归功于Hp感染防治和食物储存技术的提高,但发达国家却出现了贲门癌和胃食管连接癌的发病率上升,可能与生活方式层面的改变有关。
值得警惕的是,发病年龄≤50岁的早发型胃癌,在一些国家正逐渐抬头,而早发型胃癌可能与自身免疫性胃炎、抗生素及抑酸药滥用导致的肠道微生物失调有关,此外还有遗传层面的影响。
整体而言,晚期胃癌(含胃食管连接癌)仍是预后最差的癌症之一,患者5年生存率仅有约6%,通过有效的系统性药物治疗,尤其是精准靶向和免疫治疗改善患者生存是当务之急。而谈到精准治疗,就得从胃癌的基因和分子特征谈起。
胃癌的分子特征
2012年开始有研究揭示,约40%的胃癌存在EGFR、HER2等受体酪氨酸激酶表达,带动了早期的靶向治疗探索;随后在2014年,癌症基因组图谱(TCGA)计划进一步描述了胃癌分子特征,并提出胃癌的四个分子亚型,即:EB病毒阳性型(EBV)、微卫星不稳定型(MSI)、基因组稳定型(GS)、染色体不稳定型(CIN)[2]。
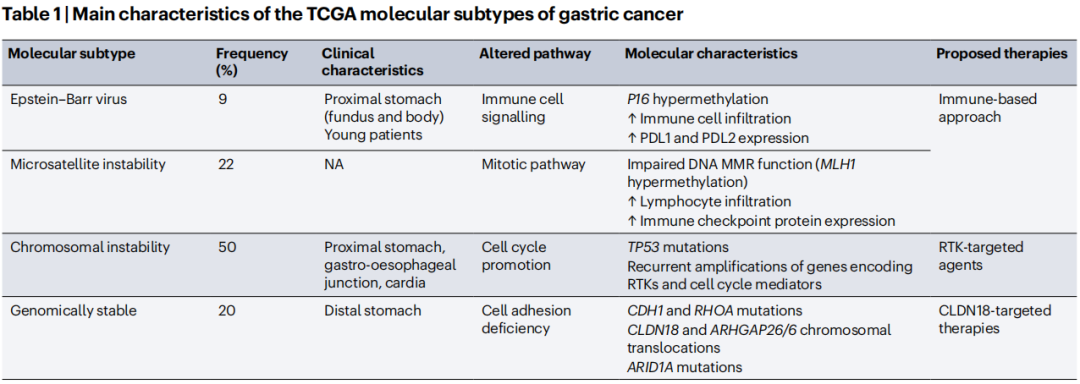
TCGA提出的胃癌分子分型特点汇总
TCGA提出的胃癌分子分型中,EBV型和MSI型患者术后预后相对较好,CIN型可从辅助化疗中显著获益,一部分MSI型患者还适合使用免疫检查点抑制剂(ICIs),而GS型患者预后最差[3],后续研究证实这一分子分型,可能也适用于胃食管连接癌(类似CIN型)。
虽然未在临床广泛使用,但TCGA分子分型提出的胃癌异质性(患者间/肿瘤内异质性),或许能解释许多胃癌关键临床研究的失利,因为它们没有用分子特征筛选患者。而与其它实体瘤类似,胃癌原发灶和转移灶、治疗前和治疗后,也存在分子特征的差异,Hp感染和肠道微生物对胃癌分子特征的影响也亟待明确。
胃癌精准治疗——艰难的探索之路
既往胃癌的药物治疗自然是以化疗为主,在围术期化疗和晚期姑息性化疗中,挑大梁的都是铂类药物(奥沙利铂、顺铂)和氟嘧啶类药物(氟尿嘧啶、卡培他滨),近年来又多了本文开头提到的抗HER2单抗(曲妥珠单抗)和PD-1/L1抑制剂们。
但总体而言,目前的胃癌药物治疗倒真算不上精准治疗,这也不是科学家和医生们不努力,实在是因为过去有太多临床II/III期研究以失败告终,不过近年来精准治疗也有一些可喜的进展,以下就按照精准治疗药物的类型来逐个盘点吧。
HER2靶向治疗
2010年曲妥珠单抗+化疗方案关键临床III期研究TOGA取得成功,在一线治疗中显著延长了HER2阳性晚期胃癌患者的总生存期(OS,13.8个月 vs. 11.1个月,HR=0.74,P=0.0046),标志着晚期胃癌治疗有了第一个靶向药物。
但此后其它靶向HER2的大分子单抗(如帕妥珠单抗)、小分子酪氨酸激酶抑制剂(TKI,如拉帕替尼)和抗体偶联药物(T-DM1),却接连在关键临床研究中失利,都没能成功延长晚期患者(一线或二线治疗)的OS,制约这些药物临床获益的,除了靶向治疗必然遭遇的耐药,还可能是患者肿瘤内HER2表达的异质性。
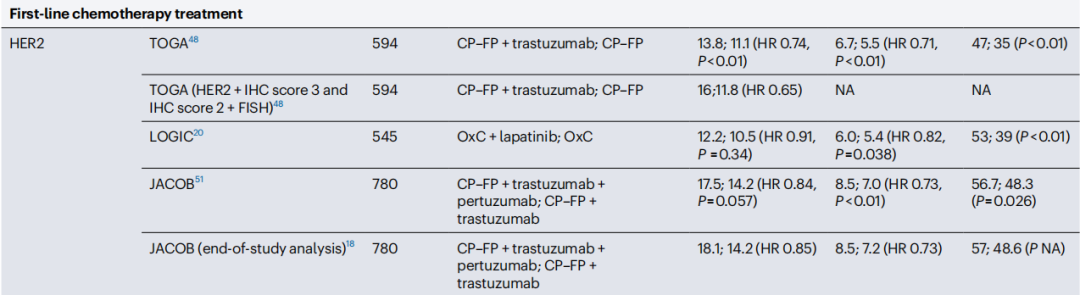
TOGA研究及其它失败的HER2阳性胃癌一线治疗研究数据
直到新一代抗体偶联药物T-DXd出现,才打破了HER2靶向治疗只有曲妥珠单抗“独苗”的困局,基于DESTINY-Gastric01研究的OS显著获益[4],T-DXd已在欧美获批晚期三线治疗,且使用还有望继续前移,用于二线乃至一线治疗。
值得关注的HER2靶点新药还有小分子TKI Tucatinib、HER2双特异性抗体Zanidatamab等,还有研究在含曲妥珠单抗方案的基础上,联合免疫治疗或抗血管生成类靶向药,例如已报告客观缓解率阳性结果的KEYNOTE-811研究[5]等,新型药物和创新联合方案能否成功治疗HER2低表达患者,也是当前的关注焦点。
另外,曲妥珠单抗±帕妥珠单抗+化疗的联合方案,还在探索局部晚期胃癌的新辅助治疗,并报告了可观的临床II期研究结果,患者病理学完全缓解(pCR)率可达35%,无病生存期(DFS)也表现优秀[6],目前临床研究已推进到III期阶段。
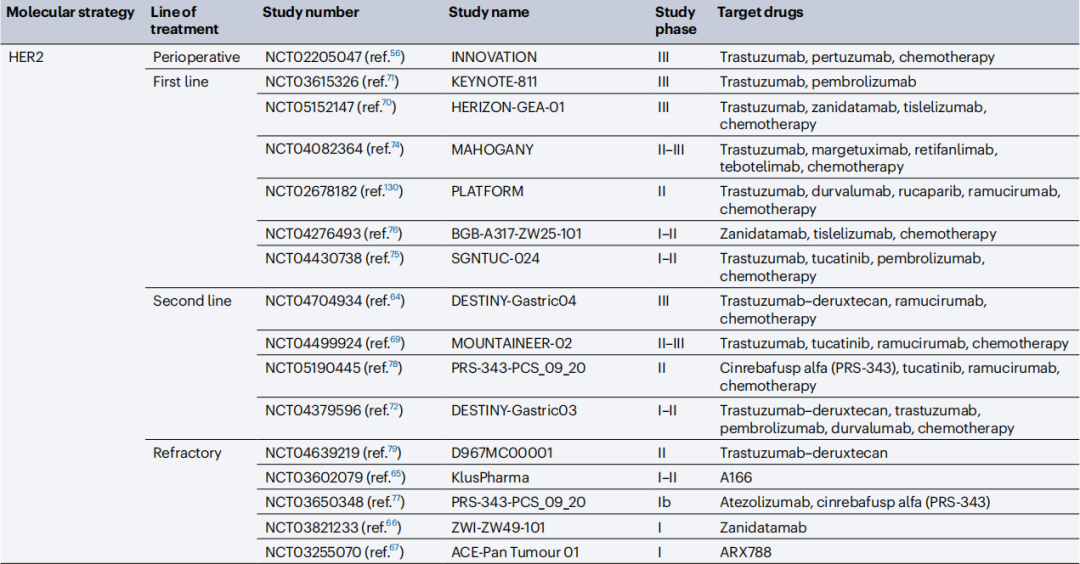
正在进行中的部分HER2阳性胃癌/胃食管连接癌重要临床研究
免疫治疗
TCGA胃癌分子分型已经提示,一部分胃癌患者可能是ICIs治疗的理想人群,因此PD-1/L1抑制剂们很早就踏上了征途,从2017年报告阳性结果的ATTRACTION-2研究(纳武利尤单抗三线治疗)开始,临床研究取得了许多重要成果。
基于CheckMate-649、ORIENT-16两项关键临床III期研究结果[7-8],PD-1抑制剂联合含铂化疗(FOLFOX/XELOX),已成为国内外临床指南推荐的HER2阴性晚期胃癌一线治疗标准方案,但主要获益的是PD-L1表达CPS≥5的患者,PD-L1低表达患者获益尚不明确;此外MSI-H/dMMR患者也可尝试免疫单药治疗。
含ICIs的联合治疗方案也是当前的重要探索方向,不过除KEYNOTE-811研究外成果还不多。此外还有大量研究探索以免疫治疗作为新辅助/辅助治疗,但在辅助治疗的临床III期CheckMate-577研究(食管癌+胃食管连接癌)中,胃食管连接癌患者亚组并无显著DFS获益[9],看来免疫新辅助/辅助治疗也不是一蹴而就。
抗血管生成类药物
胃癌细胞往往存在较高的血管内皮生长因子(VEGF)表达,且能够分泌促血管生成的细胞因子,为抗血管生成类靶向药的使用提供了理论依据,不过目前国内外仅有雷莫西尤单抗、阿帕替尼等寥寥几种药物取得临床研究成功,获批晚期二线/三线治疗适应证,但生存获益相当有限,也缺少精准指导用药的Biomarker。
其它靶点的治疗探索
在上述几类精准治疗药物以外,胃癌靶向治疗的既往探索就可以说是斑斑血泪史了,像针对EGFR、MET靶点的单抗类靶向药或小分子TKI,都在一线治疗的关键临床III期研究中失利,PARP抑制剂奥拉帕利、靶向mTOR通路的依维莫司,也都没能成功拿下二线治疗适应证。
相比这些“旧”治疗靶点,近年来一些针对胃癌治疗新靶点,例如成纤维细胞生长因子受体2(FGFR2)、Claudin 18.2的创新治疗药物,已报告了可喜的初步疗效,例如靶向FGFR2b的First-in-class单抗Bemarituzumab,就在一线治疗的II期研究中显著延长了患者中位PFS和OS[10],目前已推进到临床III期研究阶段。
而且FGFR2、Claudin 18.2等靶点的在研新药,都是不同类型齐头并进,靶向FGFR2的有大分子单抗也有小分子泛FGFR-TKI,Claudin 18.2更是集齐了单抗、双特异性抗体、抗体偶联药物乃至以CAR-T为代表的细胞疗法,就看谁能脱颖而出了。
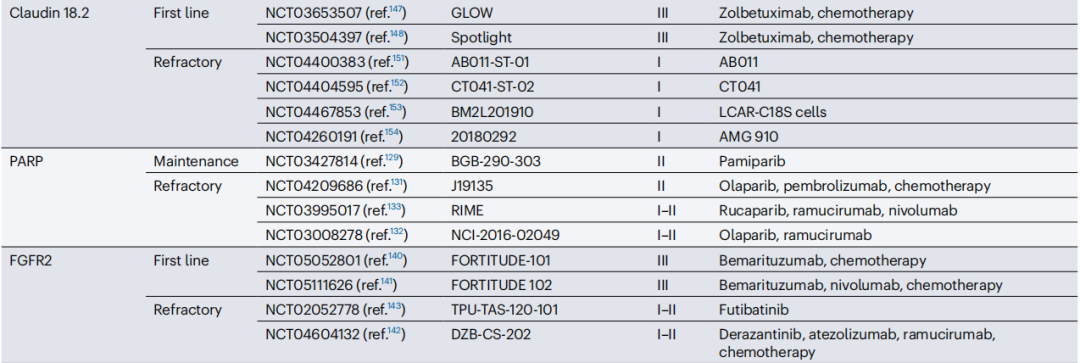
正在进行的FGFR2、Claudin 18.2和PARP靶点治疗胃癌临床研究
胃癌精准治疗的未来探索方向
如果说未来的胃癌临床研究,应该从既往的大量失败研究中吸取什么教训,那么“用生物标志物选择患者”绝对要被刻到每一份设计中,另外还需重视胃癌较强的患者异质性。而由于胃癌发病中位年龄较大(接近65岁),患者普遍因癌症相关症状身体较为虚弱,研究中也应重视对患者的动态监测和个体化照护。
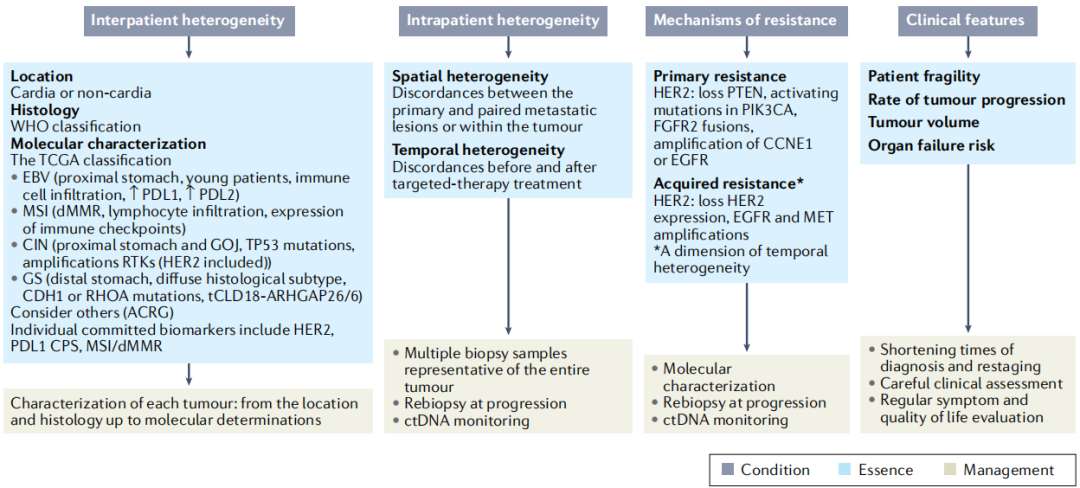
胃癌的部分突出特征及其对精准治疗构成的挑战
而在治疗策略方面,虽然目前可用的胃癌精准治疗药物并不多,但随着针对新靶点的创新药物成果井喷,未来胃癌治疗也有望像非小细胞肺癌一样,全面进入由精准检测指导的精准治疗时代,学界已经在尝试开展篮子试验,基于胃癌患者特定突变情况或基因组特征推荐治疗方案,并继续寻找胃癌中的罕见突变[11-12]。
总结
在癌症治疗的新时代,绝不能将胃癌再视为一种“单一的疾病”,需要根据肿瘤组织学类型、分子特征等因素对患者进行分类,并采取相应的精准治疗策略,未来更应在确诊时就完善分子和基因检测,充分评估患者的肿瘤时空异质性,真正实现个体化治疗胃癌,改善患者的生存期和生活质量。
参考文献:
[1]Alsina M, Arrazubi V, Diez M, et al. Current developments in gastric cancer: from molecular profiling to treatment strategy[J]. Nature Reviews Gastroenterology & Hepatology, 2022.
[2]Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma[J]. Nature, 2014, 513(7517): 202-209.
[3]Sohn B H, Hwang J E, Jang H J, et al. Clinical significance of four molecular subtypes of gastric cancer identified by the cancer genome atlas project[J]. Clinical Cancer Research, 2017, 23(15): 4441-4449.
[4]Shitara K, Bang Y J, Iwasa S, et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer[J]. New England Journal of Medicine, 2020, 382(25): 2419-2430.
[5]Janjigian Y Y, Kawazoe A, Yañez P, et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer[J]. Nature, 2021, 600(7890): 727-730.
[6]Hofheinz R D, Merx K, Haag G M, et al. FLOT versus FLOT/Trastuzumab/Pertuzumab perioperative therapy of human epidermal growth factor receptor 2–positive resectable esophagogastric adenocarcinoma: a randomized phase II trial of the AIO EGA study group[J]. Journal of Clinical Oncology, 2022, 40(32): 3750-3761.
[7]Janjigian Y Y, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. The Lancet, 2021, 398(10294): 27-40.
[8]Xu J, Jiang H, Pan Y, et al. LBA53 Sintilimab plus chemotherapy (chemo) versus chemo as first-line treatment for advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma (ORIENT-16): First results of a randomized, double-blind, phase III study[J]. Annals of Oncology, 2021, 32(Supplement 5): S1331.
[9]Kelly R J, Ajani J A, Kuzdzal J, et al. Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer[J]. New England Journal of Medicine, 2021, 384(13): 1191-1203.
[10]Wainberg Z A, Enzinger P C, Kang Y K, et al. Bemarituzumab in patients with FGFR2b-selected gastric or gastro-oesophageal junction adenocarcinoma (FIGHT): a randomised, double-blind, placebo-controlled, phase 2 study[J]. The Lancet Oncology, 2022, 23(11): 1430-1440.
[11]Catenacci D V T, Moya S, Lomnicki S, et al. Personalized Antibodies for Gastroesophageal Adenocarcinoma (PANGEA): A Phase II Study Evaluating an Individualized Treatment Strategy for Metastatic DiseasePersonalized Antibodies for Gastroesophageal Adenocarcinoma[J]. Cancer Discovery, 2021, 11(2): 308-325.
[12]Nakamura Y, Taniguchi H, Ikeda M, et al. Clinical utility of circulating tumor DNA sequencing in advanced gastrointestinal cancer: SCRUM-Japan GI-SCREEN and GOZILA studies[J]. Nature Medicine, 2020, 26(12): 1859-1864.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


