《细胞·代谢》:益生菌或可缓解暴食障碍!中国科学家揭示压力+节食导致的过度进食障碍神经通路,受肠道微生物及其代谢产物调节
来源:奇点糕 2023-11-02 13:12
肠脑轴研究的快速进展帮助我们理解了很多疾病的“另一层”机制,包括多种神经退行性疾病和神经发育障碍,近年来,也有研究发现,OD患者的肠道微生物发生了显著变化[1,2],而且来自胃
肠脑轴研究的快速进展帮助我们理解了很多疾病的“另一层”机制,包括多种神经退行性疾病和神经发育障碍,近年来,也有研究发现,OD患者的肠道微生物发生了显著变化[1,2],而且来自胃肠道的信号分子可以影响特定的大脑功能和相关行为,与进食和食物选择偏好有关的行为也包含其中[3,4]。不但如此,肠道微环境和中枢神经系统的活动同时受到压力和节食影响。
据此,中国科学技术大学生命科学与医学部熊伟教授、上海精神卫生中心临床心理科陈珏主任,以及安徽医科大学李敏博士联合开展了一项研究,揭示了OD的肠脑轴机制,即节食与压力联合导致肠道中乳杆菌和瘤胃球菌减少,代谢物犬尿酸水平降低,使得肠迷走神经-孤束核-丘脑室旁核环路的过度兴奋,驱动了过度进食行为,补充益生菌普氏栖粪杆菌可改善OD症状。研究结果发表在《细胞·代谢》杂志上[5]。
受到人类OD患者发展过程的启发,研究人员构建了一个阶段性节食和足底电击产生压力,以致OD的小鼠模型,相比健康对照小鼠,OD小鼠复刻了人类OD患者的关键特征,相比普通食物,对好吃且热量高的奥利奥饼干表现出更多的偏好,奔向奥利奥的速度更快,总热量摄入显著增加。
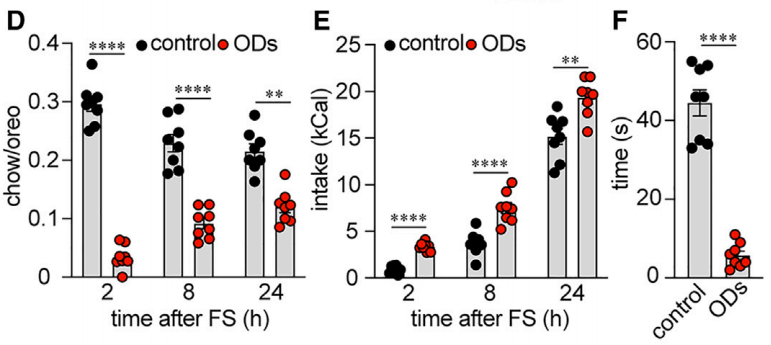
对照组(黑)和OD小鼠(红)摄入普通食物/奥利奥比值(D),总热量(E)和奔向奥利奥所花的时间(F)
值得注意的是,单独的节食或压力应激并未引起小鼠OD,必须二者同时满足。
非OD模型小鼠在经广谱四联抗生素治疗后,大部分肠道微生物被消灭,也出现了一定程度的过度进食行为,并且在接受健康小鼠的粪菌移植后得到缓解。由此,研究人员怀疑,肠道微生物可能发挥了重要作用。
利用16S rRNA测序,研究人员发现,OD小鼠肠道中乳杆菌科和瘤胃球菌科细菌丰度显著下降,这两个属中包含了多种益生菌,相应的,一种代谢产物——犬尿酸的合成水平也随之下降。
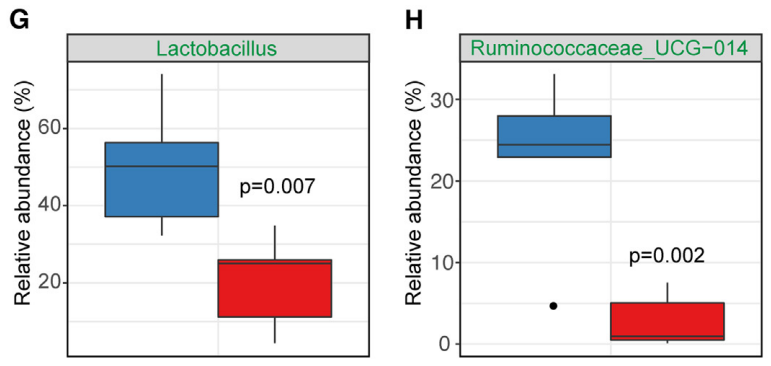
对照组(蓝)和OD小鼠(红)乳杆菌属(G)和瘤胃球菌属(H)的相对丰度差异
同时,利用光遗传学等多种技术,研究人员发现,OD小鼠大脑中丘脑室旁核(PVT)过度激活,PVT是成瘾和能量收集的关键脑区,这一次,研究人员证实,它是介导OD的核心所在。
进一步的实验发现,肠道迷走神经末梢表达抑制性犬尿酸受体,而节食和压力导致小鼠肠道微生物变化,犬尿酸合成减少,从而驱动了肠道迷走神经-孤束核-PVT通路的过度激活,小鼠出现OD。
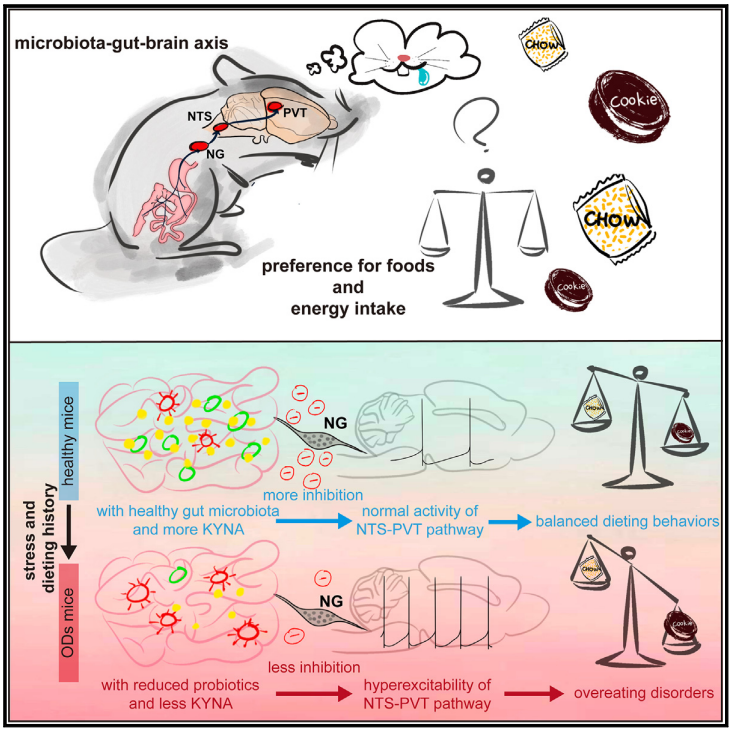
机制示意图
在11名临床诊断为神经性贪食症(BN)的女性患者中,与同龄、同性别和同BMI,饮食习惯健康的对照组相比,肠道微生物组出现明显分离,在属水平上,患者栖粪杆菌属细菌显著减少,其中普氏栖粪杆菌的减少是产生这种变化的主要原因,患者也存在和小鼠一样的犬尿酸水平的下降。
基于这些结果,研究人员尝试给OD小鼠移植了普氏栖粪杆菌,和他们预料的一样,移植后,OD小鼠对高热量美味食物的偏好和过度进食行为得到了纠正,犬尿酸水平显著增加。
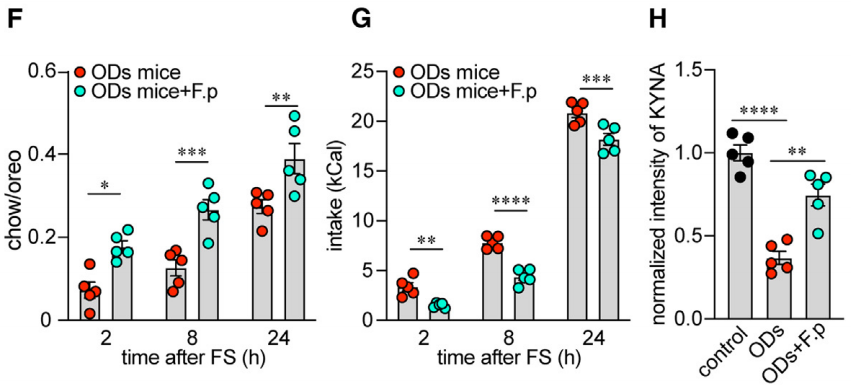
OD小鼠(红)和补充普氏栖粪杆菌的OD小鼠(绿)的摄入普通食物/奥利奥比值(F)、总热量(G)和犬尿酸水平正常化程度(H)
综上所述,这项研究揭示了压力和节食导致的OD是由特定肠道微生物及其代谢物犬尿酸减少,介导了肠道迷走神经-孤束核-PVT过度激活导致的,补充普氏栖粪杆菌可以显著改善OD相关食物选择偏好的过度进食行为,为OD提供了潜在的治疗策略。
研究人员还提出,正确的食物选择对保持健康至关重要,当饮食相对丰富时,动物的大脑可能更倾向于选择均衡的饮食,当食物稀缺和压力增加时,则可能更倾向于高热量食物,这是动物更加灵活地应对自然选择压力的一种方式。本研究进一步补充了,肠脑轴作为自适应调节器的重要性,通过感知环境变化,控制大脑对不同类型食物的渴望。
参考文献:
[1] Chu, Derrick M., and Kjersti M. Aagaard. Eating for trillions[J]. Nature, 2016, 532(7599): 316-317.
[2] Terry S M, Barnett J A, Gibson D L. A critical analysis of eating disorders and the gut microbiome[J]. Journal of Eating Disorders, 2022, 10(1): 154.
[3] Kaelberer M M, Buchanan K L, Klein M E, et al. A gut-brain neural circuit for nutrient sensory transduction[J]. Science, 2018, 361(6408): eaat5236.
[4] Tan H E, Sisti A C, Jin H, et al. The gut–brain axis mediates sugar preference[J]. Nature, 2020, 580(7804): 511-516.
[5] Fan S, Guo W, Xiao D, et al. Microbiota-gut-brain axis drives overeating disorders[J]. Cell Metabolism, 2023.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


