Cell Stem Cell:北京大学王凯团队等开发快速生成功能性血管类器官的新方法
来源:生物世界 2025-06-18 14:18
该研究确定了一个利用正向编程驱动干细胞快速生成血管类器官的新方法,摆脱了传统类器官制备所需的基质胶和生长因子,极大地改善了血管类器官的异质性,降低了分化成本,具有广泛应用前景。
血管类器官(Vascular Organoid,VO)已成为心血管研究领域的重要模型,通过人多能干细胞(hPSC)定向分化为内皮细胞、血管壁细胞等,可以构建出具有可灌注功能的三维血管网络。此类模型不仅能够模拟内皮细胞与血管壁细胞之间的动态相互作用,还可复现器官特异的血管微环境。
血管类器官在模拟血管发育、血管疾病、药物筛选和再生医学等多个方向均展现出巨大的潜力。然而,当前的分化方案还存在诸多问题,包括分化异质性大、所需时间长、基质胶和生长因子依赖、成本高昂、血管细胞不成熟,以及体内成血管能力低等,这些问题限制了血管类器官在血管研究以及临床转化的潜力。
2025 年 6 月 13 日,北京大学基础医学院/血管稳态与重构全国重点实验室/细胞稳态与衰老性重大疾病北京研究中心王凯课题组与美国哈佛医学院/波士顿儿童医院 Juan Melero-Martin 团队合作(博士后公丽岩为第一作者)在 Cell Stem Cell 期刊发表了题为:Rapid generation of functional vascular organoids via simultaneous transcription factor activation of endothelial and mural lineages 的研究论文【1】。
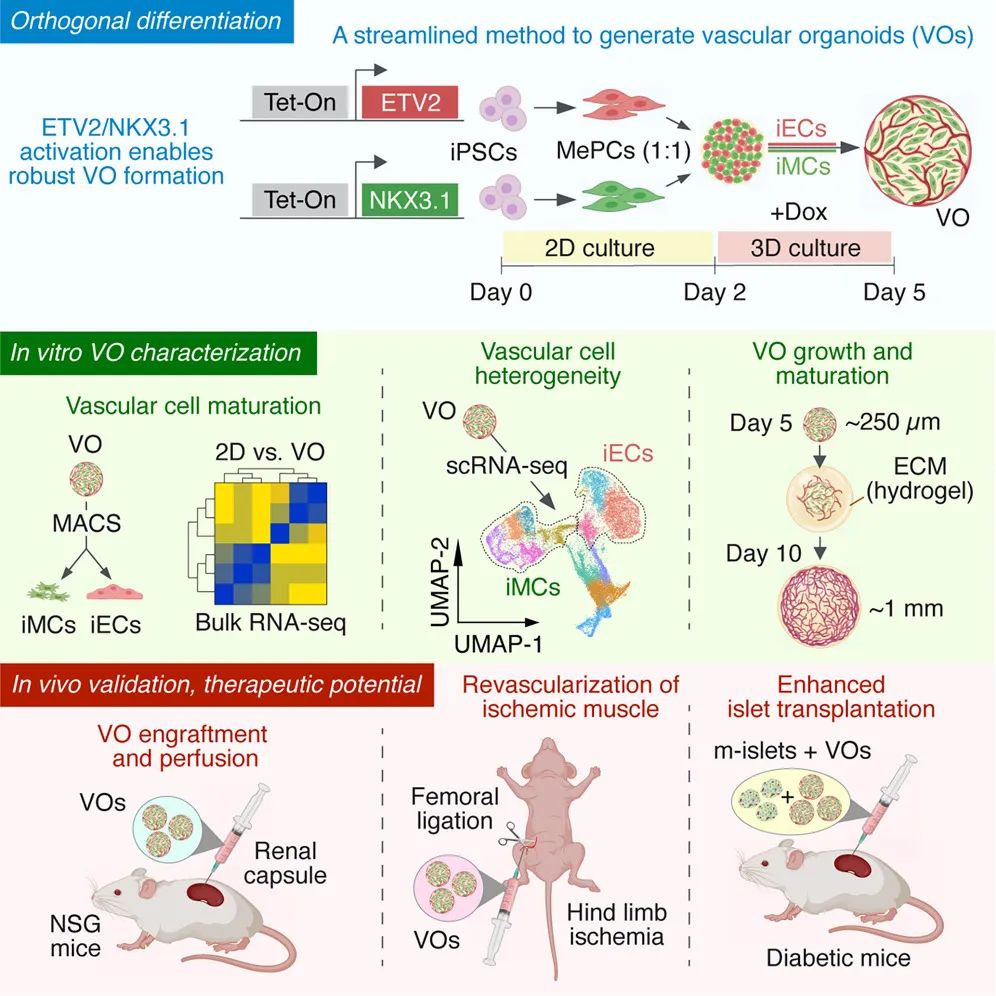
该研究开发了一种通过正交激活血管细胞命运决定转录因子 ETV2 和 NKX3.1 以快速生成功能化血管类器官的新方法,该方法能够在 5 天内从 iPSC 大量生成尺度大小均一的血管类器官,并建立了可调控的血管谱系差异模型,还在缺血再灌注治疗和胰岛移植中的展示了其应用潜力。

血管对于几乎所有组织来说都是必不可少的,它们输送营养物质和氧气,调控止血以及炎症反应。在发育过程中,血管系统塑造器官形成,并支持出生后的组织生长和修复。血管微环境也维持着干细胞群。因此,重建功能性的血管网络,对于基础血管生物学和转化血管生物学而言都是至关重要的。
功能性血管需要两种关键的细胞类型:内皮细胞(EC)和血管壁细胞(MC)。确定这些细胞的可靠来源一直是血管工程的核心问题。最初的方法依赖于从血管中分离原代细胞,这种方法的应用范围有限。诱导多能干细胞(iPSC)技术改变了这一领域,提供了可扩展的、自体来源的血管细胞。
此前,该团队已通过瞬时激活转录因子 ETV2 和 NKX3.1,分别将 iPSC 高效分化为诱导内皮细胞(iEC)和诱导血管壁细胞(iMC),表明了血管类器官中最主要的两种细胞类型都可以通过激活转录因子进行正向编程的方式获得,这为接下来血管类器官分化新方案的研究打下了坚实基础。
在这项最新研究中,研究团队提出了一种通过使用多西环素诱导或 modRNA 调控系统对转录因子 ETV2 和 NKX3.1 进行正交激活,从而从诱导多能干细胞(iPSC)生成血管类器官(VO)的简化方法。
该方法采用转录因子 ETV2 与 NKX3.1 的正交激活策略,分别诱导 iPSC 向内皮细胞和血管壁细胞分化,通过预诱导中胚层祖细胞(Mesoderm Progenitor Cell,MePC),再将两种初步诱导的 iPSC 按 1:1 混合并 3D 培养,在 5 天时间内即可形成直径约 250 μm、结构统一的功能性血管类器官,且无需细胞外基质。这些血管类器官在嵌入细胞外基质后会进一步成熟,形成了更大且结构更完善的血管。
接下来,研究团队通过单细胞 RNA 测序揭示了这些血管类器官中血管细胞的异质性,不同转录因子诱导时长会导致血管谱系偏倚:短时激活 ETV2(1天)更易获得动脉样 iEC,而长时激活(3天)则促进静脉样或具更高血管新生潜能的 iEC,在体内移植中形成更多灌注血管。这一可调控的“命运开关”,为未来按需构建特定类型血管网络提供了工具。
进一步体内实验表明,将这些血管类器官植入免疫缺陷小鼠体内后,形成了有血液灌注的血管,并在下肢缺血模型和胰岛移植模型中促进了血管重建。
该研究的核心发现:
通过正交激活转录因子,可从 iPSC 快速生成血管类器官;
iEC 和 iMC 的同时分化驱动成熟且功能正常的血管形成;
转录因子激活时间调节血管细胞的身份和异质性;
血管类器官可在缺血和移植模型中植入并重建血管系统
总的来说,该研究确定了一个利用正向编程驱动干细胞快速生成血管类器官的新方法,摆脱了传统类器官制备所需的基质胶和生长因子,极大地改善了血管类器官的异质性,降低了分化成本,具有广泛应用前景,为血管建模、疾病研究和再生细胞疗法提供了一个快速且多用途的血管类器官平台。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


