Nat Cancer:三种免疫检查点抑制剂联合使用有望治疗胰腺癌
来源:生物谷原创 2023-01-20 13:02
在一项新的研究中,研究人员发现了一种新型的三种免疫疗法的联合使用,靶向T细胞和髓样抑制细胞中的免疫检查点,成功地重编程了肿瘤免疫微环境,并大大改善了胰腺癌临床前模型中的抗肿瘤反应。
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员发现了一种新型的三种免疫疗法的联合使用,靶向T细胞和髓样抑制细胞(myeloid-derived suppressor cell, MDSC)中的免疫检查点,成功地重编程了肿瘤免疫微环境(tumor immune microenvironment,TIME),并大大改善了胰腺癌临床前模型中的抗肿瘤反应。相关研究结果近期发表在Nature Cancer期刊上,论文标题为“Targeting T cell checkpoints 41BB and LAG3 and myeloid cell CXCR1/CXCR2 results in antitumor immunity and durable response in pancreatic cancer”。

在这项新的研究中,这些作者在小鼠和人类胰腺癌中使用了全面的免疫分析,以系统地确定免疫疗法抵抗性机制并研究潜在的治疗靶标。他们发现,中和肿瘤免疫微环境的几种不同的免疫抑制机制极大地提高了实验室模型的生存率,指出了这种极其致命的无反应性的癌症的潜在治疗方案。
论文共同通讯作者、德克萨斯大学MD安德森癌症中心癌症生物学教授Ronald DePinho博士说,“这种三联免疫疗法在我们的模型中导致了前所未有的治愈性反应。普遍的观点是胰腺癌对免疫疗法无能为力,但这项临床前研究表明,胰腺癌在正确的联合疗法面前也会很脆弱。此外,这些靶标在人类胰腺癌样本中的存在,提出了令人兴奋的可能性,即这种治疗组合有一天可以帮助我们的患者。”
胰腺癌是美国癌症死亡的主要原因之一,部分原因是80%的病例是在晚期诊断出来的。胰腺癌也被认为是“非免疫原性的”,意味着它对常用的抗PD-1和抗CTLA-4免疫检查点抑制剂没有反应。这部分是由于肿瘤免疫微环境中的免疫抑制条件造成的,但这种抵抗背后的机制还没有完全被理解。
这些作者使用高维免疫分析和单细胞RNA测序来研究肿瘤免疫微环境如何受到多种免疫疗法的影响。他们确定了特定的免疫检查点蛋白---41BB和LAG,它们在功能衰竭的T细胞中高度表达。
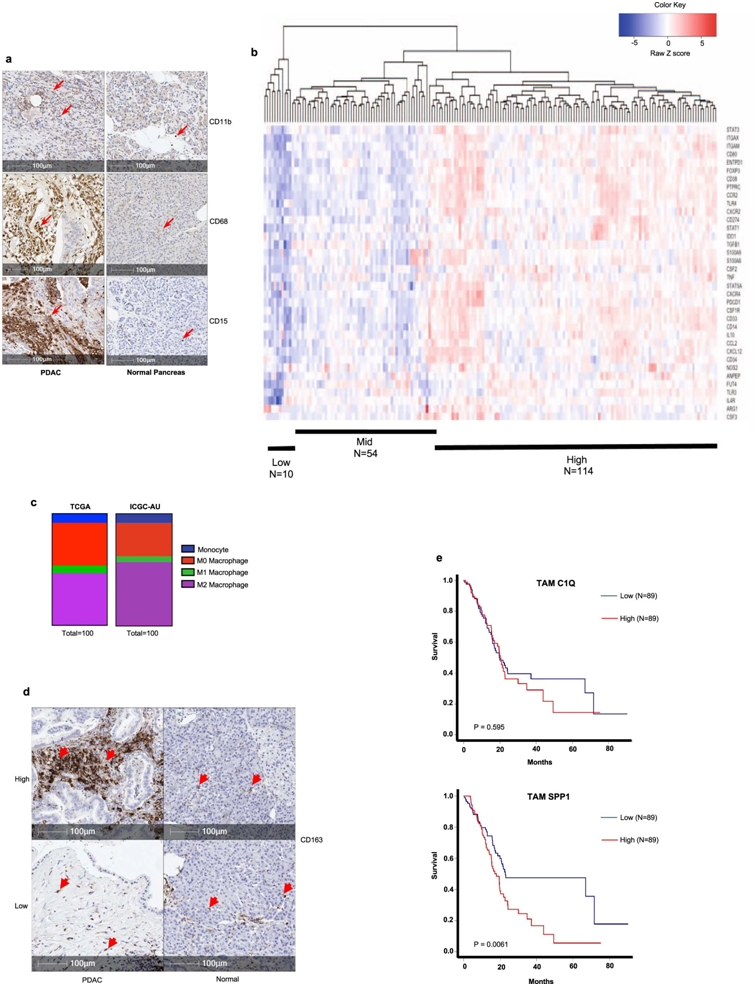
人胰腺导管腺癌(PDAC)中髓样抑制细胞显著浸润。图片来自Nature Cancer, 2022, doi:10.1038/s43018-022-00500-z。
在测试针对这些免疫检查点的抗体时,这些作者观察到,与单独使用任何一种抗体或其他免疫检查点抑制剂的治疗相比,使用41BB激动剂和LAG3拮抗剂联合治疗的动物模型中的肿瘤进展速度更慢,抗肿瘤免疫指标水平更高,生存率也明显提高。值得注意的是,这些临床前研究忠实地反映了人类数据中缺乏抗PD1或抗CTLA-4疗法的疗效。他们还证实这两种治疗靶标存在于人类胰腺癌样本中:81%和93%的被分析患者的T细胞分别有41BB和LAG3表达。
鉴于这种双重组合疗法没有完全消除已建立的肿瘤,他们还研究了对肿瘤免疫微环境进行重编程以进一步使肿瘤对免疫疗法敏感的努力。在基线时,肿瘤免疫微环境含有大量表达CXCR2的髓样抑制细胞,CXCR2是一种与招募免疫抑制细胞有关的蛋白。单独抑制CXCR2会减少MDSC的迁移并阻断肿瘤的生长,但这并不是治愈性的。这促使他们考虑组合靶向41BB、LAG3和CXCR2。
正是这种三重组合,在90%的临床前模型中导致了肿瘤的完全消退并改善了总生存率。在一种更严格的会出现多个自发产生的肿瘤并具有更高的治疗抵抗性的实验室模型中,该三重组合在超过20%的病例中实现了肿瘤的完全消退。
DePinho说,“这些是令人鼓舞的结果,特别是考虑到胰腺癌缺乏有效的免疫疗法选择。通过靶向阻碍免疫反应的多种协同机制,我们可以给T细胞一个攻击这些肿瘤的战斗机会。当然,我们仍然需要看到这种组合如何在临床上转化为一种安全和有效的方案,我们邀请其他研究人员在这些结果的基础上进行研究。我们乐观地认为,胰腺癌,以及希望其他非免疫原性癌症,最终都能在联合免疫疗法中变得脆弱。”
这些作者指出,这些特殊的免疫疗法药物目前正作为单体疗法进行临床试验,这表明有可能将这种三联疗法迅速转化为临床研究。(生物谷 Bioon.com)
参考资料:
Pat Gulhati et al. Targeting T cell checkpoints 41BB and LAG3 and myeloid cell CXCR1/CXCR2 results in antitumor immunity and durable response in pancreatic cancer. Nature Cancer, 2022, doi:10.1038/s43018-022-00500-z.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


