Science Immunology | 胞毒性T淋巴细胞驱动细胞毒性的生物力学特征
来源:生物探索 2024-07-21 09:57
de Jesus等人开发了一种高分辨率方法,用于分析免疫细胞的机械输出并识别描绘功能不同的细胞亚群的关键特征,比较了CD8细胞毒性T淋巴细胞(CTL)与其他免疫细胞施加的界面力模式。
所有尺度上的生命都伴随着力学与化学耦合的过程,免疫系统尤其如此【1】。
为应对这种复杂的生命过程,免疫细胞已经进化到具有结构可塑性,在不同组织之间动态改变形状,且具有物理活性,向周围环境传递力量。力的施加使免疫细胞能够感知刚度和压力等物理参数,从而影响其激活状态、基因表达、代谢等细胞行为。例如,研究已经证明力可以调节B细胞获取抗原、CD8细胞毒性T淋巴细胞(CTL)杀死感染或转化的靶细胞【2, 3】。尽管免疫细胞感知和传递机械力,但这些力究竟是如何组织的,以及这种组织在多大程度上控制免疫功能仍然知之甚少。
来自美国纽约纪念斯隆凯特琳癌症中心的Morgan Huse实验室在Science Immunology上以Research Article发表了题为Single-cell topographical profiling of the immune synapse reveals a biomechanical signature of cytotoxicity的研究成果。为了解决这些问题,de Jesus等人开发了一种高分辨率方法,用于分析免疫细胞的机械输出并识别描绘功能不同的细胞亚群的关键特征,比较了CTL与其他免疫细胞施加的界面力模式。他们发现在免疫突触内,CTLs形成了一个复杂的压缩陨石坑,是一种特殊的生物力学特征,与启动吞噬作用的巨噬细胞和参与非裂解相互作用的T细胞不同。这些发现表明,免疫细胞对其靶标施加特殊的力学模式,以执行不同的免疫功能。

为了刻画免疫突触的力学特征,该团队使用了三维的超分辨率牵引力显微镜(super-resolution traction force microscopy, TFM)系统。在这个系统中,T细胞被诱导可与可变形的聚丙烯酰胺-丙烯酸微粒(DAAM粒子)形成物理活性突触(图1A)。每个颗粒表面的3D测量可以亚微米分辨率可视化CTL突触引起的物理变形。他们发现:CTL不仅扩散在DAAM颗粒上,而且还被推入其中,将接触区域压缩成直径~10 μm的突触“陨石坑”(图1B和C)。CTL突触包含两个地形带:以正曲率为主的外围“陨石坑边缘”和以凹陷为特征的内部“陨石坑底”(图1D)。陨石坑底部是高度动态的。他们进一步发现CTL-DAAM颗粒突触中得陨石坑底与局部细胞骨架重塑引起(F-肌动蛋白的结构)有关。
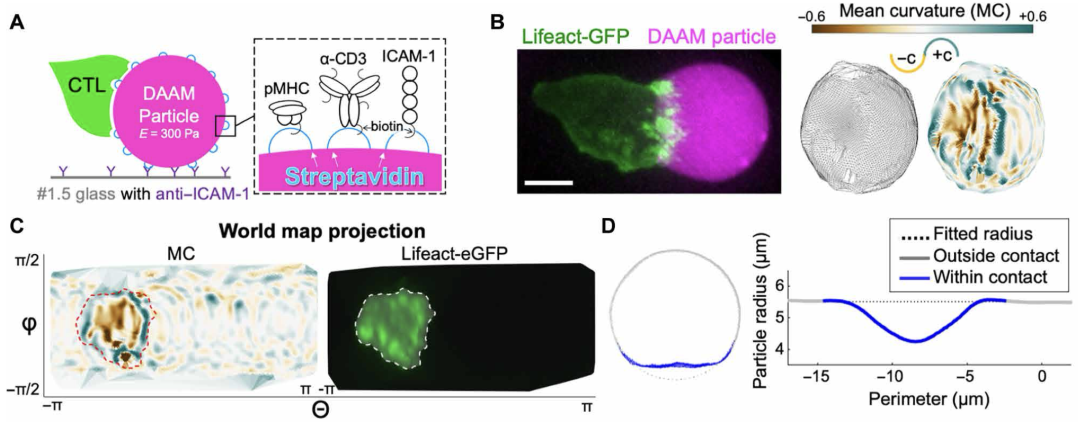
图1 CTL形成压缩的、拓扑结构复杂的突触(Credit: Science Immunology)
CTL与靶细胞接触后,含穿孔素和颗粒酶的溶解颗粒运输到突触,在那里它们通过F-肌动蛋白网的间隙进入质膜。这些颗粒的胞外融合过程称为脱粒,导致穿孔素和颗粒酶定向释放到细胞间隙。Morgan Huse实验室早在2016年的Cell文章中发现跨突触施加的力的大小与靶细胞上穿孔素孔形成速度之间存在惊人的相关性,进而促进CTL杀伤【3】。在这篇文章中,他们进一步可视化施加力的同时观察脱颗粒。为了探索这一想法,他们开发了一个基于连续弹性理论(continuum elastic theory)的计算模型来研究基于F-肌动蛋白的突出力(protrusive forces)与靶标变形(target distortion)之间的相互作用。正如预期的那样,这两个指标都随着F-肌动蛋白覆盖率的增加而增加。然而,F-肌动蛋白的组织也很重要,较大的簇诱导更明显的畸变。
为了进一步证实全局压缩、微模式突触拓扑结构是否是细胞毒性增强的特征,他们研究了缺乏F-actin依赖的力调节因子的CTL。他们重点关注两个肌动蛋白成核促进因子: WASp和WAVE2和一种支架蛋白Talin(是一种将整合素偶联到F-肌动蛋白皮层从而使力通过突触LFA-1传递)。他们发现Talin缺乏显着削弱了抗压强度和突起形成,而WASp和talin的缺失损害了突触内凸起的产生。相比之下,缺乏WAVE2的CTL没有表现出这些机械缺陷。此外,缺乏脂质磷酸酶PTEN的CTL在体外具有更强的细胞毒性,并发挥更强的F-肌动蛋白依赖性突触作用力。作者们也发现在与刺激性DAAM粒子的结合中,PTEN缺陷的CTLs形成了更深的突触压缩陨石坑,表明整体压缩更强,并在靶标表面上诱发了更多的凸面特征。
接下来,该团队研究了以上力学指标是否也能描述体内产生的CD8+ T细胞分化状态的功能差异。特征识别表明,其抗压强度(compressive strength)和突出活动(protrusive activity)依次为: Tn < Texh ≈ Tmem < Teff(图2)。这一结果表明,T细胞耗竭不仅包括转录和分泌反应,还包括生物力学的输出。

图2 机械活性区分CD8+ T细胞不同分化状态(Credit: Science Immunology)
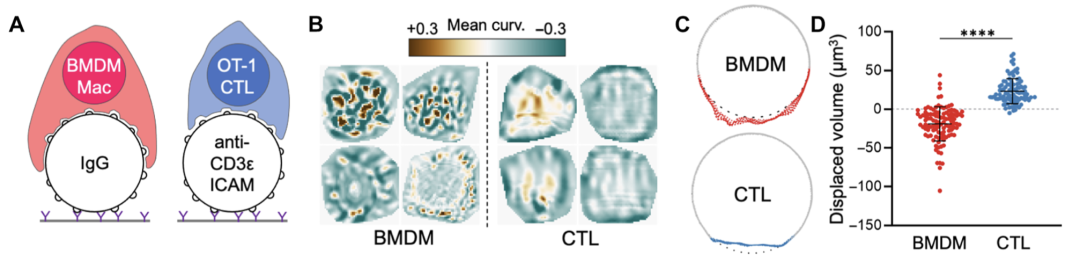
图3 巨噬细胞和T细胞利用相反的机械活性(Credit: Science Immunology)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


