Cell Death & Differentiation:早老素基因突变通过降低铁死亡促进神经退行性病变
来源:生物谷原创 2022-04-29 14:54
虽然β斑块在病理上定义了阿尔茨海默病(AD),但这种多肽在引发神经变性中的因果作用仍然存在争议。
虽然β斑块在病理上定义了阿尔茨海默病(AD),但这种多肽在引发神经变性中的因果作用仍然存在争议。家族性阿尔茨海默病(FAD)是一种侵袭性的常染色体显性遗传病,由早老素(PS)1、PS2或淀粉样蛋白(Aβ,Aβ)前体蛋白(APP)突变引起,这些突变都与Aβ的产生有关。
PS是γ-分泌酶的催化亚基,它裂解APP形成Αβ。突变往往使APP的切割倾向于形成更长、更难溶的42和43个氨基酸的Aβ,而不是更易溶的40个氨基酸的多肽。
虽然PS突变对增加Αβ42/40比率的影响已被强调为神经退行性毒性的特征,但体外对138个家族性PS突变的系统分析显示,42/40比率并未持续升高,更有说服力的是,这些突变中有90%降低了活性,导致Aβ40和42的产生减少,正如在其他几项研究中观察到的那样。这与疾病发病的功能丧失机制是一致的,这并不令人惊讶,因为散布在整个早老素基因中的200多个突变都是通过共同的功能获得而导致疾病的可能性很小。

图片来源: https://doi.org/10.1038/s41418-022-01003-1
近日,来自墨尔本大学的研究者们在“Cell Death & Differentiation”杂志上发表了题为“Selective ferroptosis vulnerability due to familial Alzheimer’s disease presenilin mutations”的文章,该研究证明早老素基因突变可能通过降低铁死亡来促进神经退行性变,这对疾病修正疗法具有重要意义。
早老素1和2(PS1和PS2)突变导致常染色体显性遗传性家族性阿尔茨海默病(FAD)。自从新皮质铁负荷预测阿尔茨海默病(AD)的进展以来,铁死亡被认为是AD神经退行性变的一种机制。
研究者发现,早老素的丢失显著地使多种类型的细胞对铁死亡敏感,但不会导致细胞凋亡。早老素的FAD原因突变类似地使细胞对铁死亡敏感。早老素促进Gpx4的表达,Gpx4是一种硒蛋白检查点酶,通过抑制致命的过氧化氢自由基的膜传播来阻止铁死亡。
由于LRP8是硒蛋白P的摄取受体,因此早老素γ分泌酶活性可将Notch-1裂解为信号LRP8,进而通过调节细胞内硒的供应来控制Gpx4的表达,因此Se的摄取被早老素Fad突变破坏,从而抑制Gpx4的表达。
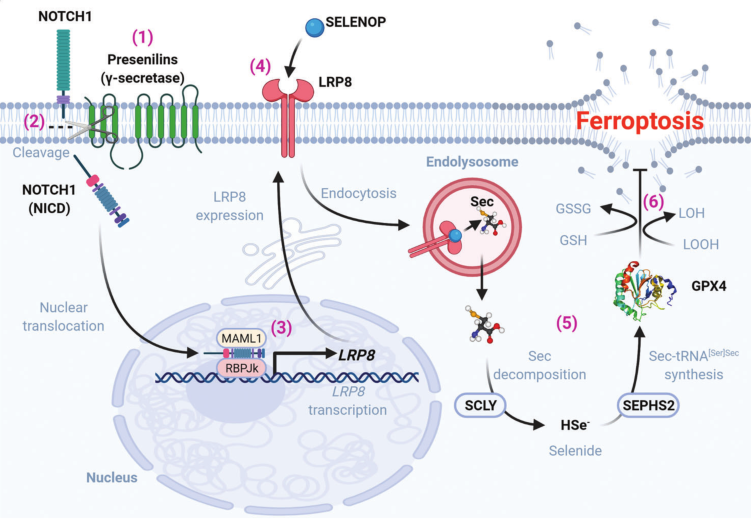
γ分泌酶功能丧失引起铁死亡应激的机制
图片来源: https://doi.org/10.1038/s41418-022-01003-1
总体而言,该研究表明,无论Aβ如何,早老素突变都有可能促进神经退行性变,这可能是也可能不是额外的毒性损害。因此,拯救铁死亡的药物,如铁螯合剂、脑可及硒治疗(不依赖于SELENOP)、谷胱甘肽前体和自由基捕捉剂可能具有治疗AD的潜力。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


