Mol Metabol:科学家识别出关键蛋白调节低密度脂蛋白胆固醇背后的特定分子机制
来源:生物谷原创 2023-02-09 09:46
来自蒙特利尔大学等机构的科学家们通过研究在理解涉及人类心血管疾病和特定癌症发生的机制上又迈出了重大一步,文章中,他们发现了一种特殊的分子机制,即蛋白质PCSK9能降解低密度脂蛋白(LDL)的受体。
近日,一篇发表在国际杂志Molecular Metabolism上题为“Molecular interactions of PCSK9 with an inhibitory nanobody, CAP1 and HLA-C: Functional regulation of LDLR levels”的研究报告中,来自蒙特利尔大学等机构的科学家们通过研究在理解涉及人类心血管疾病和特定癌症发生的机制上又迈出了重大一步,文章中,他们发现了一种特殊的分子机制,即蛋白质PCSK9能降解低密度脂蛋白(LDL)的受体,而低密度脂蛋白是血液中最丰富的胆固醇颗粒。
LDL能在血液中积累并导致动脉粥样硬化和心脏病发生,LDL和与LDL相关的胆固醇(LDLc)的水平能被LDL受体(LDLR)调节从而从血液中收集LDL并将其内化,主要是进入到肝脏细胞中,细胞表面的LDLR能驱动LDL进入到所捕获的细胞中,随后LDLR就能返回到细胞表面进行另一轮捕获。大多数的家族性高胆固醇血症都与LDLR的功能失调有关,但更为罕见的癌症却与PCSK9蛋白相关,PCSK9存在于血液中,其与LDLR相关且能促进其被肝脏细胞所降解,并能预防其返回到细胞表面来捕获LDL,某些高胆固醇血症患者往往拥有超级“PCSK9”,其或能增强LDLR的降解。
科学家识别出关键蛋白调节低密度脂蛋白胆固醇背后的特定分子机制。
图片来源:Molecular Metabolism (2022). DOI:10.1016/j.molmet.2022.101662
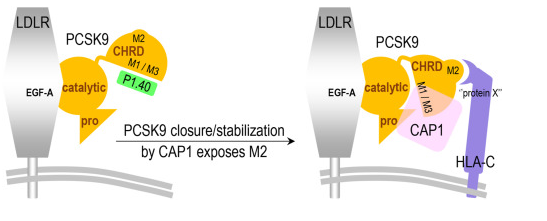
近年来,有效的治疗性手段已经能用来抑制患者机体血液中PCSK9的功能(利用单克隆抗体)或减少其水平(利用RNAi技术),从而就导致LDLR的数量更大,并能确保相比常规他汀类药物而言使得LDLc的水平下降60%以上。如今研究人员揭开了此前被误解的机制,即PCSK9能将LDLR拖向溶酶体,而在溶酶体中细胞就能降解PCSK9-LDLR复合体。在实验室中,研究者Seidah等人通过进行结构分析揭示了这三种PCSK9伴侣蛋白复合体的形成过程,即LDLR, CAP1和HLA-C。
作为免疫系统的关键蛋白,HLA-C在其中就扮演着关键角色,其能将整个复合体引向溶酶体,HLA-C还能促进自身的识别,并刺激T淋巴细胞的抗肿瘤活性。PCSK9则能通过增加细胞表面HLA-C的水平来阻断肿瘤的生长以及相关的癌症转移。最终,研究人员希望能开发出新型抑制剂开预防PCSK9和HLA-C之间的相互作用,并阻断PCSK9对LDLR和HLA-C的功能。
这一研究突破有望应用于相应的临床实践,从而治疗心血管病变、多种癌症以及患者机体的癌症转移。综上,本文研究中,研究人员识别出了CHRD-P1.40复合体的三维结构,从而理解了P1.40、CAP1和PCSK9之间错综复杂的相互作用以及其调节LDLR降解背后的分子机制。(生物谷Bioon.com)
原始出处:
CaroleFruchart Gaillard,Ali Ben Djoudi Ouadda,Lidia Ciccone, et al. Molecular interactions of PCSK9 with an inhibitory nanobody, CAP1 and HLA-C: Functional regulation of LDLR levels, Molecular Metabolism (2022). DOI:10.1016/j.molmet.2022.101662
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


