《癌细胞》:紫杉醇大不同!中国科学家发现,白蛋白结合型紫杉醇可召集肥大细胞,提升三阴性乳腺癌免疫治疗效果
来源:奇点糕 2025-02-10 09:09
在三阴性乳腺癌(TNBC)的免疫+化疗联合治疗中,白蛋白结合型紫杉醇(Nab-PTX)可以通过呼叫“神秘外援”——肥大细胞,更好地增强抗肿瘤免疫应答!
近日,国家癌症中心/中国医学科学院肿瘤医院马飞、刘芝华、徐兵河、张园园等研究者与北京大学生物医学前沿创新中心张泽民团队合作,在Cancer Cell期刊发表的最新研究成果就揭示:在三阴性乳腺癌(TNBC)的免疫+化疗联合治疗中,白蛋白结合型紫杉醇(Nab-PTX)可以通过呼叫“神秘外援”——肥大细胞,更好地增强抗肿瘤免疫应答!
研究显示,Nab-PTX相比普通紫杉醇具有更适用于免疫+化疗方案的两大优势,首先就是它能扩增肥大细胞和促炎性巨噬细胞,而肥大细胞恰恰是募集和激活T细胞和B细胞等免疫细胞、增强免疫应答的关键;另一方面,Nab-PTX也能使TCF7+干细胞样效应记忆CD8+T细胞(Tsem)和CD4+滤泡辅助T细胞(Tfh)发生显著重编程,这可能解释了在既往临床III期研究中,PD-L1抑制剂与Nab-PTX而非紫杉醇联合,才能显著改善患者预后[1]。
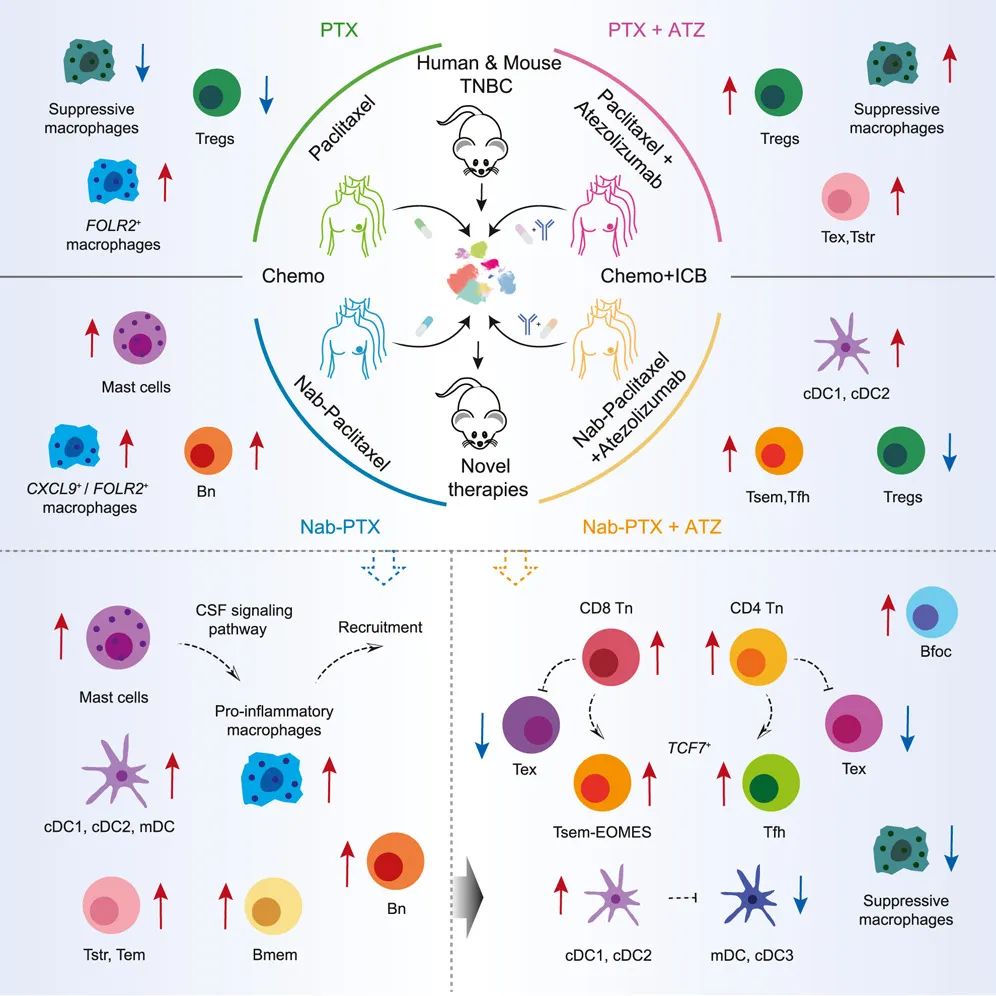
一图总结论文核心内容
其实早在2021年,开展本次研究的我国学者们就对PD-L1抑制剂联合紫杉醇治疗晚期TNBC时,肿瘤微环境发生的动态变化进行过全方位分析[2];但后来在临床研究中,Nab-PTX和紫杉醇分别联合PD-L1抑制剂治疗的结果一成一败(即IMpassion130/131研究),就说明Nab-PTX和紫杉醇对TNBC肿瘤微环境和免疫应答的影响可能不尽相同。
所以这回,研究者们共纳入了44例接受四种不同治疗方案,即紫杉醇或Nab-PTX单药±PD-L1抑制剂(阿替利珠单抗)治疗晚期TNBC患者的原发灶和转移灶单细胞测序结果,通过分析免疫细胞的成分和表型差异来寻找答案。
对CD8+T细胞的分析首先显示,Nab-PTX+阿替利珠单抗治疗患者的耗竭CD8+细胞毒性T细胞(Tex-GZMB)相对较少,且在对联合治疗有应答的患者中Tsem亚群占比增加,它们主要由幼稚T细胞或耗竭亚群转化而来,Nab-PTX+阿替利珠单抗治疗也会起到助力作用(Tsem主要由阿替利珠单抗激活),它们也会阻止部分CD8+T细胞向耗竭表型分化;同时,部分不利于免疫应答的CD8+T细胞则减少,两方面加起来就使CD8+T细胞整体状态变好了。
相比之下,紫杉醇+阿替利珠单抗治疗就不会带来类似增益,甚至会使CD8+T细胞耗竭更多,不过这个责任可能是免疫治疗的,联合治疗反而会使紫杉醇本身的免疫增益作用消失。而对CD4+T细胞的分析也能得出相似结论,即Nab-PTX+阿替利珠单抗治疗带来的改变更有利,如使Tfh亚群增多,而调节性T细胞(Treg)等不利亚群减少。
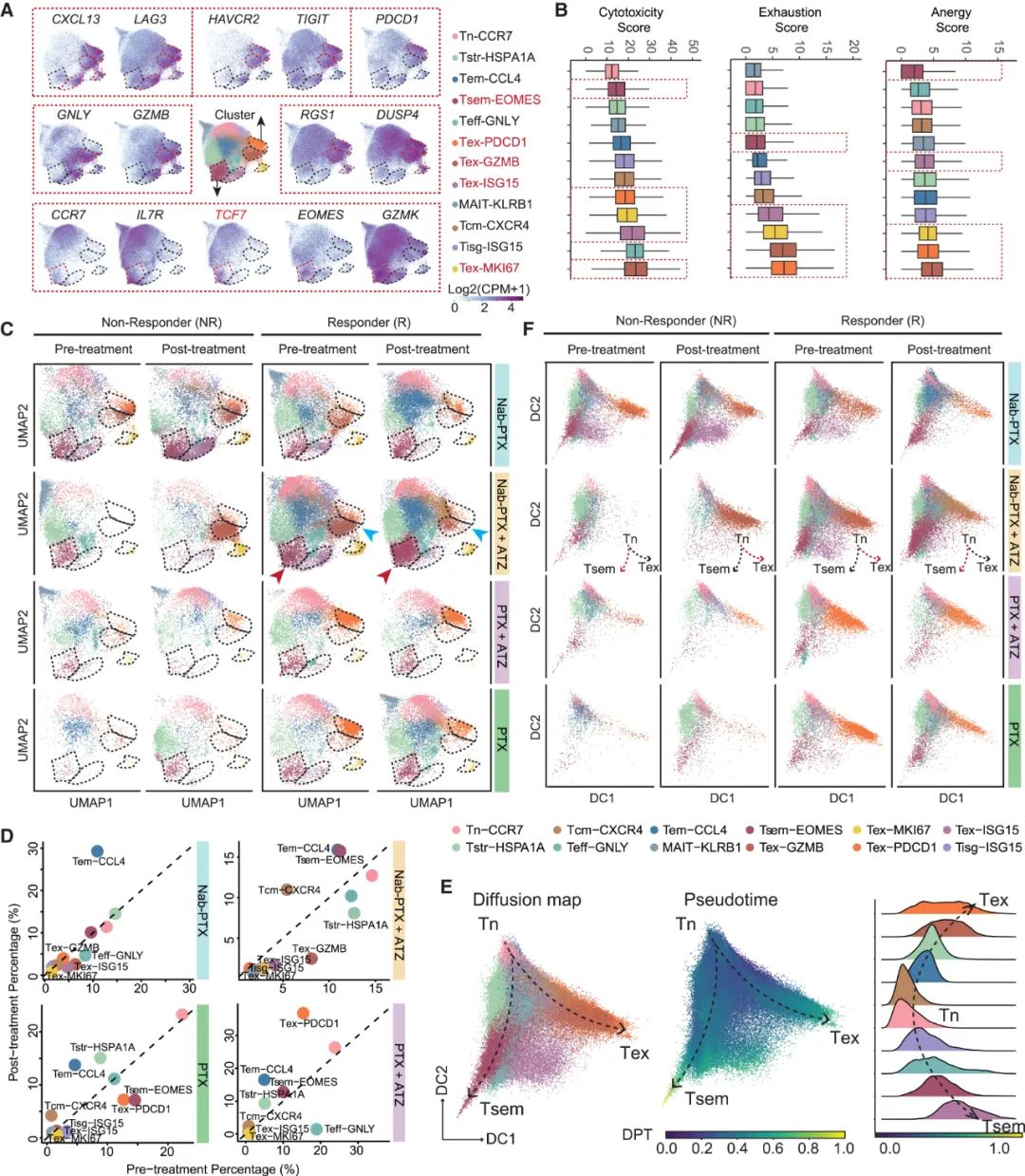
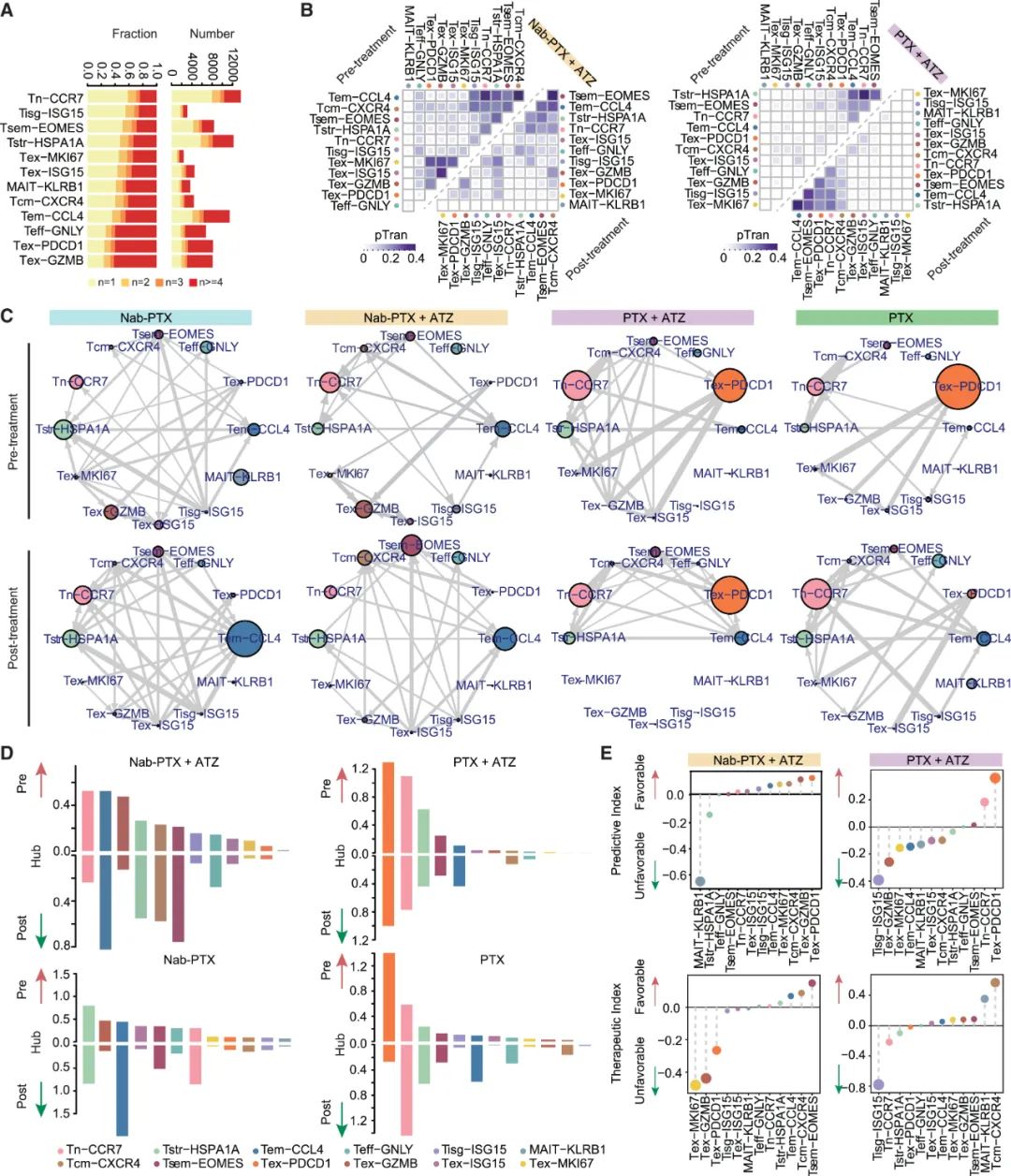
不同免疫/化疗或联合治疗方案对CD8+T细胞的影响汇总
而除了CD8+/CD4+T细胞,研究者们还注意到,对含Nab-PTX方案有应答患者的肿瘤内肥大细胞数量增多,且与Nab-PTX对CD8+T细胞的正向调节同步发生,研究者们由此推测肥大细胞可能与T细胞募集和激活有关,并用独立实验进行了证实。不过,单纯激活肥大细胞募集来的T细胞耗竭比例偏高,不足以有效抑癌,还得靠Nab-PTX+阿替利珠单抗来帮忙。
与此类似,肥大细胞还能将幼稚B细胞和记忆B细胞募集到肿瘤部位,再由Nab-PTX+阿替利珠单抗助力转化为利于免疫应答的滤泡B细胞,并借助CXCL9-CXCR3募集促炎性巨噬细胞,进一步重塑肿瘤免疫微环境,而对免疫应答不利的调节性/抑制性树突状细胞亚群,也能被肥大细胞和Nab-PTX+阿替利珠单抗方案共同打压;针对肥大细胞功能进行抑制(使用色甘酸钠阻止肥大细胞脱颗粒),就会使Nab-PTX+阿替利珠单抗的抑癌效果大打折扣。
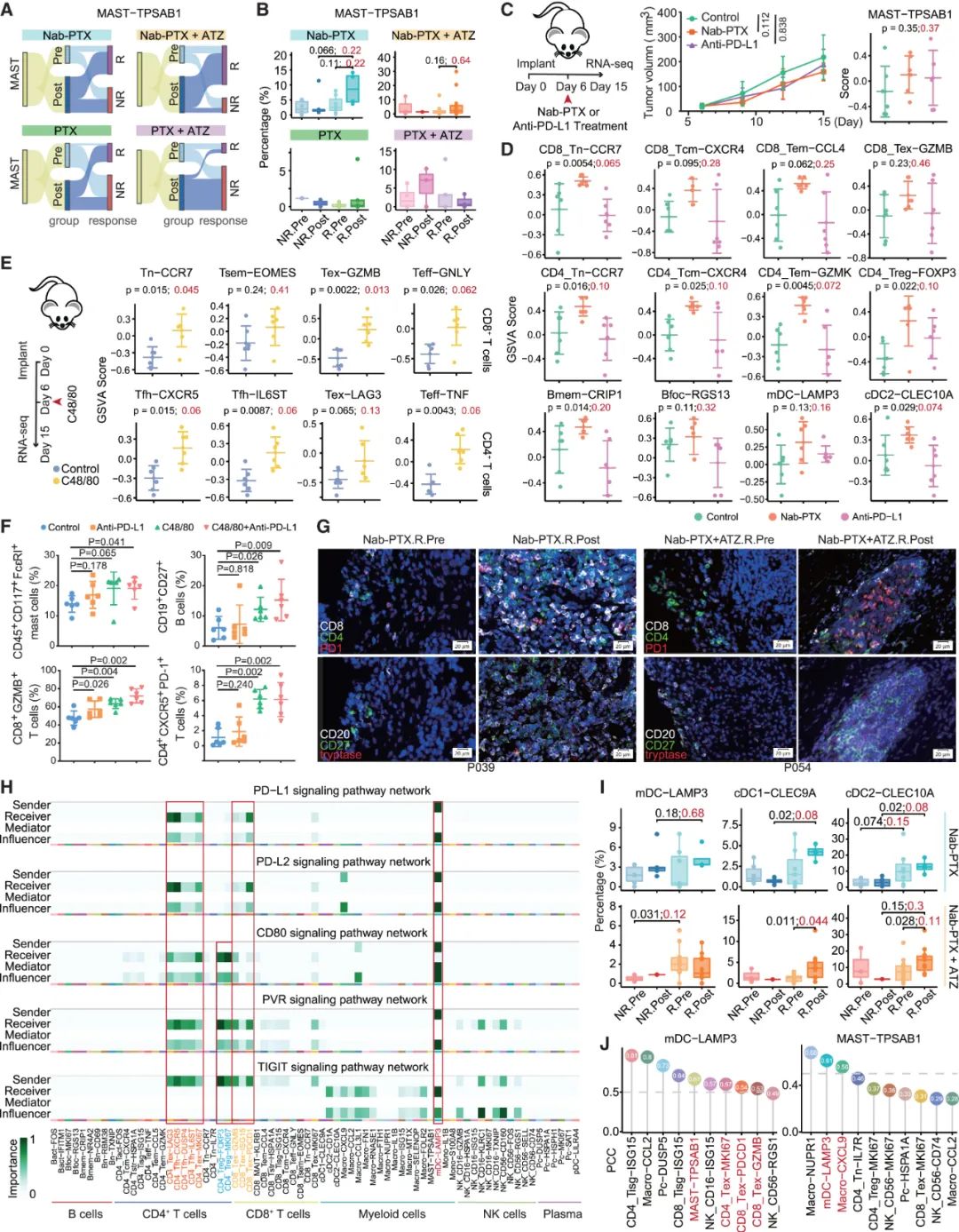
肥大细胞激活对Nab-PTX+阿替利珠单抗重塑免疫微环境、增强免疫应答不可或缺
所以说,能否激活肥大细胞来全盘重塑肿瘤微环境,可能就是Nab-PTX和紫杉醇联合免疫治疗成败与否的关键,而既然肥大细胞作用如此明显,后续研究就得好好厘清它在各方面的影响,并设法开发出尽量低毒高效(激活肥大细胞可能导致过敏反应)的干预策略啦。
参考文献:
[1]Zhang Y, Chen H, Mo H, et al. Distinct cellular mechanisms underlie chemotherapies and PD-L1 blockade combinations in triple-negative breast cancer[J]. Cancer Cell, 2025.
[2]Zhang Y, Chen H, Mo H, et al. Single-cell analyses reveal key immune cell subsets associated with response to PD-L1 blockade in triple-negative breast cancer[J]. Cancer Cell, 2021, 39(12): 1578-1593. e8.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


