新冠口服药VV116登上NEJM的背后
来源:药智网 2023-01-06 16:28
近日,《新英格兰医学杂志》(NEJM)发表一项中国非劣效性3期随机对照临床试验,其结果表明:与抗病毒药物Paxlovid相比,服用VV116的患者副作用要少,约有67%报告了副作用
近日,《新英格兰医学杂志》(NEJM)发表一项中国非劣效性3期随机对照临床试验,其结果表明:与抗病毒药物Paxlovid相比,服用VV116的患者副作用要少,约有67%报告了副作用,而服用Paxlovid的人报告了77%。
其实,关于VV116的三期临床试验,业界有很多质疑,比如主要终点为何设置为“临床恢复”而不是“预防重症及死亡”。中日友好医院副院长曹彬在12月29日撰文指出初始临床主要终点设置了转重和症状恢复时间。研究团队为了抢时间,妥协了部分严谨性,包括未开展双盲设计。
有业界专业人士戏称:“我和刘翔20秒内都能完成百米的非劣比较没有意义,这个临床设计策略存在严重失策。
其一,Paxlovid共完成三个三期,除了以转重、死亡率为主要指标的研究成功外,预防性研究和以症状改善为终点的三期临床均失败了;VV116在参比这个失败的背景下和之头对头的非劣比较就人为加大了注册风险(可能他们也在重新做了),其实与安慰剂做优效更好些;目前全球以所有症状消失时间为临床主要观察指标的新冠治疗药物,只有盐野义的恩昔特韦成功了。
其二,受试者选择不是72小时之内,拖延越久越增加偏倚,入组是好入了,结局不好说了。”
从试验过程文件,可以发现VV116临床试验最终放弃了双终点,仅保留了症状缓解时间这一个临床终点。可能是由于研究团队在试验执行过程中发现奥密克戎毒株致病性下降,导致重症事件发生概率极低。也正如预期,结果表明两组进展为重型的受试者人数为0。
在安全性方面,VV116比Paxlovid的安全性顾虑更少。VV116组的不良反应发生率低于Paxlovid组。由于Paxlovid与多种药物存在相互作用,而VV116不会抑制或诱导主要药物代谢酶,或者抑制主要药物转运蛋白,因此与合并用药发生相互作用可能性小。
我们来看一下VV116的设计思路和阻断新冠病毒复制的机理,进一步了解这款药的特点。
VV116(JT001)是中科院上海药物研究所、武汉病毒研究所和君实科技等团队开发的口服小分子药物。VV116是从GS-441524及其衍生物GS-621763改造而来。区别于靶向肝脏的瑞德西韦磷酯酰胺前药设计,VV116为三异丁酸酯前药结构,将母体核苷碱基部分C7位的氢进行氘代替换(也起到了突破专利的作用),以氢溴酸盐形式成药。
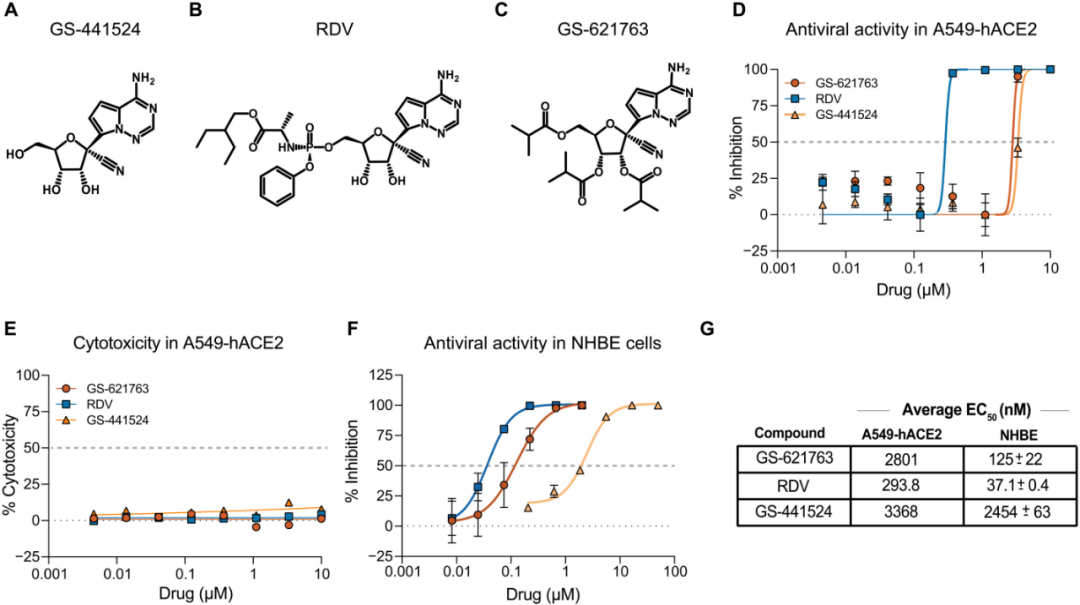
图1 母体GS441624,衍生物瑞德西韦(RDV)和GS-621763的化学结构和抗病毒活性数据。图片来源:参考资料2
改造后的VV116具有很高口服生物利用度,口服吸收后,可在体内组织广泛分布。虽然和FDA批准的瑞德西韦同属于GS441524的核苷类似物的前药(Prodrug),但与需静脉注射的瑞德西韦相比,VV116可以口服给药,具有良好的口服生物利用度。此外临床数据显示VV116表现出更好的体外抗病毒活性和选择性。VV116于去年12月获准在乌兹别克斯坦紧急使用。
在3期临床试验中,VV116与Paxlovid相比在“至持续临床恢复的时间”达到非劣效,且VV116组比Paxlovid组的中位恢复时间更短,VV116组为4天,Paxlovid组为5天。但发现感染5天后再吃几乎没有效果。
除此之外,VV116的价格在乌兹别克斯坦为185美元(约合人民币1275元),国内售价据悉定在600至1000元,约为另外两款口服治疗药物Paxrovid(京东价格2980元/盒)和莫纳皮拉韦(Molnupiravir欧美售价每盒700美元约和人民币4700元)的三分之一。
目前,我国批准使用的Paxrovid和molnupiravir药物机理也都是抑制病毒在体内复制,防止病毒增殖的抗病毒药物。在临床试验中,当在症状出现后4天内给予Paxrovid时,住院和死亡的概率降低了89%,即使在5天内给予,该比率仍高达85%。
Molnupiravir公布的临床结果显示,在症状出现后5天内给药可使住院率和死亡率降低50%,但在最终的临床分析中该效果降为30%。
由于VV116和瑞德西韦的药物机理都是通过阻断病毒遗传物质RNA的复制来抑制病毒复制的机制。瑞德西韦于2020年10月被美国FDA正式批准用于治疗住院的感染新冠病毒的重症患者,此后适用范围扩大至症状较轻的患者。FDA还宣布将瑞德西韦的使用范围扩大到儿科患者和28天或以上且体重至少3公斤的婴儿。瑞德西韦成为第一个可用于12岁以下儿童和婴儿的治疗药物侧面体现出药物的安全性较高。
VV116和瑞德西韦一样最初以非活性形式存在。因此,下图中所示的过程说明VV116从其非活性形式转变成其活性形式(三磷酸化的VV116)的步骤顺序。
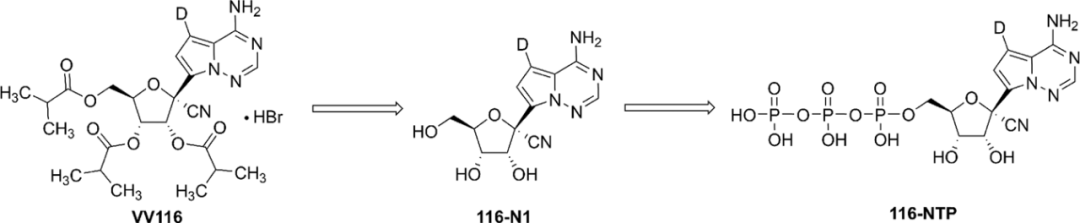
图2 VV116体内代谢为活性化合物的过程。图片来源:参考资料10
此后,三磷酸化的VV116通过与其天然的三磷酸腺苷(ATP)竞争而抑制病毒RNA聚合酶。在病毒RNA拷贝的合成过程中,通过与RNA模板另一核苷酸中的尿嘧啶碱基配对,添加了三磷酸化的VV116导致病毒子链合成的终止。这是VV-116抑制新冠毒复制而又不损害宿主细胞的能力的机制。
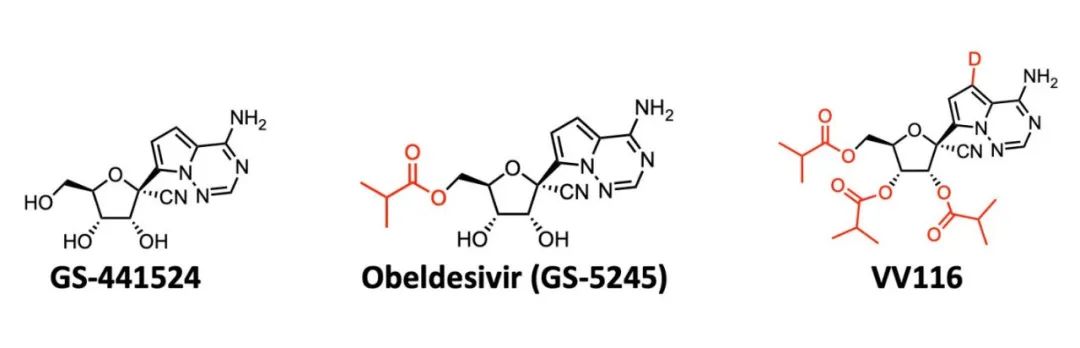
图3 基于母体药物设计的两款口服新冠病毒阻断剂的药物结构
瑞德西韦的开发者Gilead公司也在积极研发口服剂型的新药,比如有报道称用于治疗高风险患者的口服GS441524衍生物Obeldesivir(GS-5245)正在进行3期临床试验。与母体核苷GS-441524的口服给药相比,GS-5245显示出更高的口服生物利用度。这也侧面证明了VV116的确有更好的口服生物利用度。
除了VV116,目前国内在研的新冠口服药整理如下:其中先声药业与中国科学院上海药物研究所、武汉病毒研究所联合开发的SIM0417,预计最快于2023年2月上市。
在笔者整理VV116相关资料的时候看到这则新闻:当徐华强教授上个月病倒并检测出新冠病毒呈阳性时,他服用了自己发明的药片。
Paxlovid是美国主要的口服抗病毒药物,在中国供不应求。但是,徐华强教授在2021年帮助设计了自己的药物,并且作为该药物的发明者,即使在进行临床试验时也可以合法服用。
他的症状减轻了,而且他并不孤单。在《新英格兰医学杂志》上的一项822名患者的临床试验中,抗病毒药物VV116在缓解患者症状方面似乎与Paxlovid一样有效。服用VV116的新诊断患者在中位4天后康复,而Paxlovid为5天,但专家警告说,该研究的规模还不足以说一个比另一个更好。
该药物由上海君实和苏州旺山旺水等机构共同开发。
可以确定的是,这些结果可能会为疫情中的患者和医生提供一种新工具,帮助他们努力遏制迅速蔓延的疫情,同时最终为世界的武器库增加另一种抗病毒药物。
“我希望这些结果的公布能更快地获得批准,”徐教授在接受采访时说。
虽然新冠药物研发充满坎坷,但依然期待2023年,可以看到更多安全有效的新冠药物研发成功。
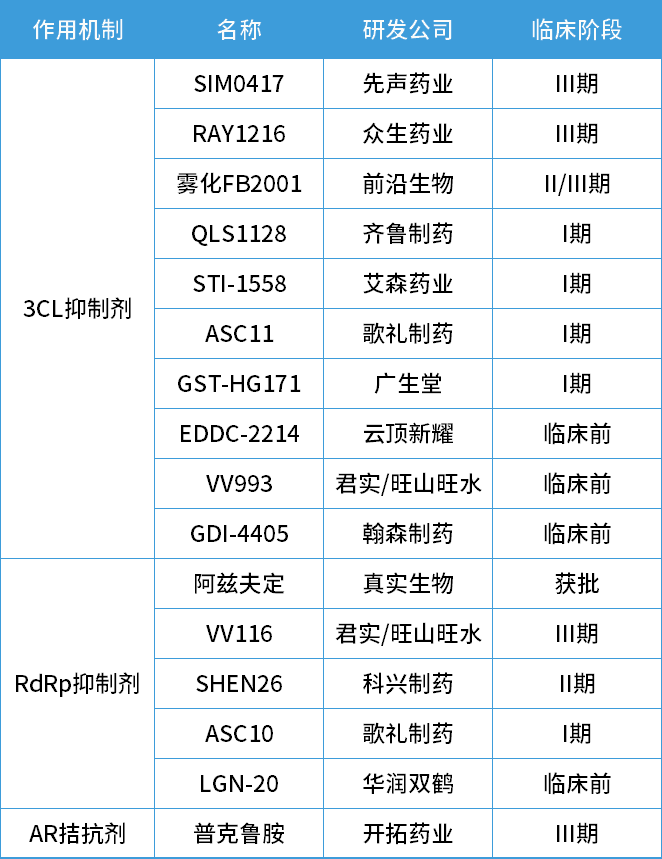
图5 国内在研新冠口服药物。图片来源:参考资料4
在此,特别缅怀被病毒夺去生命的患者,他们也许是我们的亲人,也许是普通的眼科医生,也许是药物所不停奔波的院士,也许是倒在一线的护士……
站在国内外前辈们的肩膀上,让我们一起努力,期待下一款新冠良药,源自中国,走向世界。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


