Natl Sci Rev | 中国科学院汤朝晖团队通过在替拉扎明衍生物中引入尿素以增强抗癌治疗
来源:生物探索 2024-02-14 11:43
该研究开发了具有高缺氧细胞毒性和肿瘤富集能力的TPZ衍生物,充分发挥其抗癌治疗作用。
中国科学院长春应用化学研究所汤朝晖团队在National Science Review(IF 20.7)在线发表题为“Introducing urea into the tirapazamine derivatives to enhance anti-cancer therapy”的研究论文,该研究发现在替拉扎明衍生物中引入尿素以增强抗癌治疗。该研究为了提高TPZ的治疗效果,首先引入尿素合成了一系列含尿素的TPZ衍生物。所有含尿素TPZ衍生物在保持低氧选择性的同时,其低氧细胞毒性均比TPZ高9.51~30.85倍。其中TPZP的细胞毒性比TPZ高20倍,但保持相似的低氧细胞毒性比(HCR)。
为了高效地将TPZP输送到肿瘤中并减少其对健康组织的副作用,进一步将TPZP制备成具有纤维蛋白靶向能力的纳米药物FT11-TPZP-NPs。CA4-NPs是一种血管破坏剂,可增加肿瘤内的纤维蛋白水平,加剧肿瘤缺氧。FT11-TPZP-NPs通过与CA4-NPs结合,在缺氧加重的肿瘤中大量富集,并充分激活杀死肿瘤细胞。单次给药后,FT11-TPZP-NPs + CA4-NPs对初始体积约为480 mm3的CT26肿瘤模型的抑制率高达98.1%,其中4/6肿瘤完全消除,发挥了显著的抗肿瘤作用。该研究为提高TPZ和其他HAPs在抗癌治疗中的疗效提供了新的策略。

缺氧是实体肿瘤的共同特征,被认为是肿瘤治疗的最佳靶点之一。作为生物还原活化药物,缺氧激活前药(hypoxia activated prodrugs, HAPs)可以在缺氧条件下选择性活化成高细胞毒性物质,杀死实体肿瘤中的缺氧细胞。TPZ是一种典型的HAP,对缺氧肿瘤细胞具有选择性的高细胞毒性,而对正常组织具有较低的细胞毒性。人们普遍认为,TPZ的低氧选择性是由于TPZ最初的单电子还原过程形成TPZ自由基阴离子。
TPZ自由基阴离子可以被分子氧氧化为TPZ,从而阻止随后TPZ衍生的自由基的形成,从而诱导DNA损伤。截至目前,美国食品和药物管理局(FDA)已批准了约17项与TPZ相关的临床试验。虽然TPZ在早期临床研究中显示出令人鼓舞的结果,但III期临床试验未能提高总生存率。随后的一项临床试验表明,TPZ有限的临床活性是由于患者的肿瘤缺氧程度不足以有效激活足够浓度的TPZ。因此,可以通过选择性提高肿瘤缺氧水平激活足够浓度的TPZ来增强TPZ的治疗效果。另一种方法是增加TPZ对肿瘤细胞的细胞毒性。
有多种途径可以增加肿瘤中的缺氧水平。例如,声动力疗法(SDT)或光动力疗法(PDT)可以通过增加肿瘤中的氧气消耗来增加缺氧水平。另一方面,经导管肝动脉栓塞(TACE)可引起肿瘤内血管闭塞,导致缺氧增加。然而,SDT, PDT和TACE,作为本地这些疗法并不适合治疗有转移性病变的肿瘤。肿瘤血管为肿瘤的生长提供必需的氧气和营养。
血管破坏剂(VDAs)可以有效关闭已形成的肿瘤血管,导致实体肿瘤的氧气和营养供应显著减少。VDAs不仅会导致肿瘤细胞继发性坏死,还会引发凝血级联反应,增加肿瘤中的缺氧水平。研究人员以一种具有代表性的VDA—combretastatin A4 (CA4)为基础,开发了一种纳米VDA,称为CA4- NPs。CA4-NPs可以选择性地破坏肿瘤血管,导致治疗肿瘤内出血和缺氧增加。出血引发了凝血级联反应。一开始,血小板在出血部位迅速形成一个不稳定的塞,以实现初步止血。然后,凝血因子的激活引发连锁反应,将纤维蛋白原转化为纤维蛋白,纤维蛋白进一步交联,稳定凝块,减少失血过多。也就是说,给药CA4-NPs不仅会加剧肿瘤缺氧,还会导致肿瘤内纤维蛋白的显著积累。
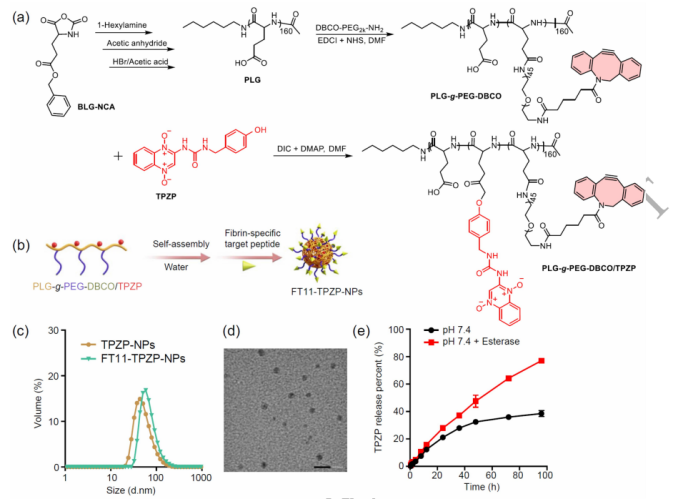
FT11-TPZP-NPs的合成及理化表征(Credit: National Science Review)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


