研究揭示机械应力促进肝癌消融后复发的调控机制
来源:中山大学 2023-08-21 10:27
近日,中山大学附属第一医院肝胆胰外科中心匡铭教授团队与精准医学研究院刘纯研究员、王骥研究员团队合作在
近日,中山大学附属第一医院肝胆胰外科中心匡铭教授团队与精准医学研究院刘纯研究员、王骥研究员团队合作在Cell Reports Medicine上发表了研究成果“Mechanical Confinement Promotes Heat Resistance of Hepatocellular Carcinoma via SP1/IL4I1/AHR Axis”,首次构建基于3D打印的肝癌热消融模型,揭示了机械应力促进肝癌细胞热抵抗并介导消融后复发的相关机制。
尽管热消融术是早期肝癌(HCC)的根治性治疗手段,但其术后复发仍是目前面临的主要临床难题,这表明部分肿瘤细胞在高温热应激下具备更强的热抵抗。肿瘤3D微环境中的机械应力能在极端条件下决定细胞命运,而目前传统的2D和动物消融模型难以对机械应力进行深入的机制探讨。因此,需要构建高度模拟体内的3D热消融模型,从3D机械应力的角度为防治HCC热消融后复发提供新辅助疗法的临床转化方案。
研究人员开发了一种基于3D生物打印的热消融模型,高保真地模拟了热消融时的连续热场分布以及细胞热应激状态,实现了更精确的热消融温度控制与监测,用于研究肿瘤细胞在真实3D环境下的热相关生物学行为。对比2D模型,HCC细胞在3D环境中展现出更强的热抵抗能力。
机制研究发现,3D环境中的机械应力驱动了HCC细胞的代谢适应,并决定了HCC细胞在热消融极端温度下的命运。结合多种热消融模型与临床样本,研究人员发现3D环境中的机械应力会导致细胞核形变,提示HCC患者消融后的不良预后。机械应力会促进转录因子SP1磷酸化水平上调以及IL4I1启动子位点的染色质开放性,介导IL4I1在3D环境中的转录水平增加。IL4I1能促进色氨酸代谢产物I3A和KynA的生成,从而激活下游的芳烃受体(AHR)信号通路,促进HCC热抵抗以及热应激后生长、侵袭和转移。最后,研究人员证实靶向阻断AHR信号通路能抑制3D环境中HCC细胞的热抵抗,从而抑制HCC热消融后肿瘤进展。
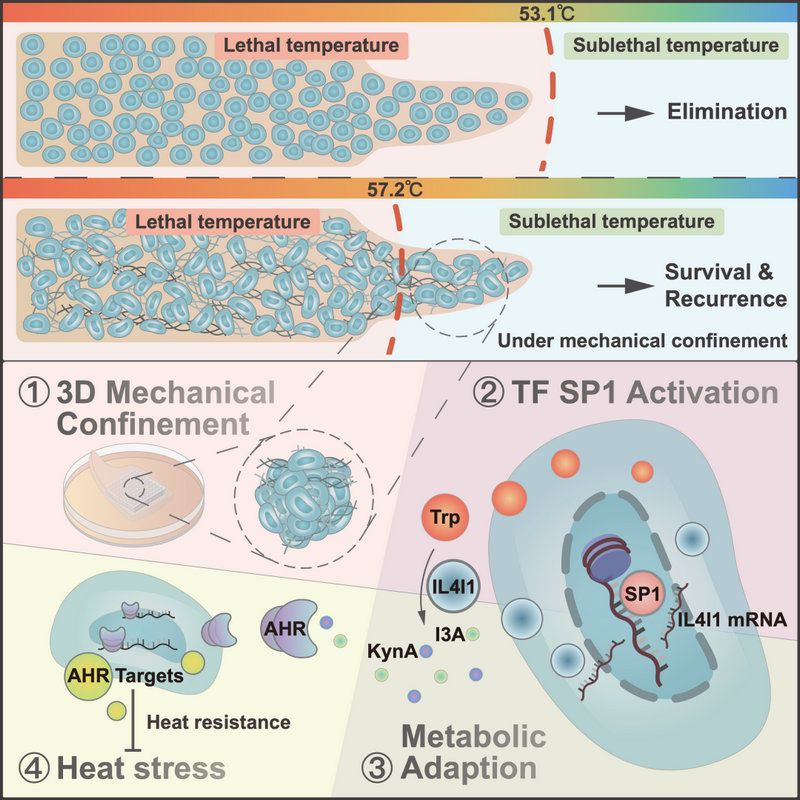
3D环境中的机械应力促进HCC消融后复发的机制。3D环境的机械应力促进SP1活化,进而上调IL4I1的表达,IL4I1介导的色氨酸代谢产物I3A和KynA通过激活下游AHR通路导致热抵抗,促进HCC消融后进展。
该研究构建了一种基于3D生物打印的热消融模型,为研究3D环境下的热相关分子机制提供了新的系统性工具,鉴定出机械应力激活的SP1/IL4I1/AHR轴在HCC消融后进展发挥着重要作用,为通过靶向抑制AHR通路提高热消融疗效提供了理论依据。中山大学附属第一医院肝胆胰外科中心博士生张国培是该论文的第一作者,肿瘤科博士生谢宗林和精准医学研究院博士生蒋娟是共同第一作者,肝胆胰外科中心匡铭教授是最后通讯作者,精准医学研究院刘纯研究员和王骥研究员是共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


