《科学》:科学家揭示新冠病毒S蛋白高清结构,有望助力疫苗和诊疗技术开发
来源:学术经纬 2020-02-21 18:17
昨日,顶尖学术期刊《科学》在线发表了一篇关于新冠病毒的最新研究论文。来自德克萨斯大学奥斯汀分校(UT Austin)的一支团队利用冷冻电镜技术,揭示了新冠病毒表面S蛋白三聚体的高清结构。这一信息对于我们了解新冠病毒如何识别和进入细胞,以及如何对其设计有效的疗法或疫苗,有着重要的指导意义。S蛋白——新冠病毒的攻城锤如果把人类的细胞比作是一座防御坚固
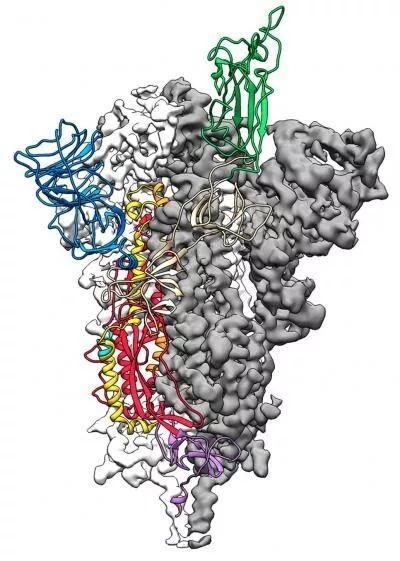
昨日,顶尖学术期刊《科学》在线发表了一篇关于新冠病毒的最新研究论文。来自德克萨斯大学奥斯汀分校(UT Austin)的一支团队利用冷冻电镜技术,揭示了新冠病毒表面S蛋白三聚体的高清结构。这一信息对于我们了解新冠病毒如何识别和进入细胞,以及如何对其设计有效的疗法或疫苗,有着重要的指导意义。
S蛋白——新冠病毒的攻城锤
如果把人类的细胞比作是一座防御坚固的城池,那么S蛋白就是新冠病毒入侵这座城池的“攻城锤”。具体来看,这是一种三聚体蛋白,有着大量糖基化的修饰。它虽然看起来像一枚长长的钉子,却会在结合细胞表面的受体后,发生“变形”,将病毒包膜与细胞膜融为一块儿,从而将病毒内的遗传物质注入细胞,感染细胞。
可想而知,如果我们能看清这个“攻城锤”的模样,就能见招拆招,找到其中的软肋,助力开发出针对新冠病毒的药物和疫苗。而冷冻电镜技术,正是一种能够让我们看清蛋白结构的工具。
3D结构揭示作用机理
根据最早报道的新冠病毒基因组序列,研究人员们表达了新冠病毒S蛋白的膜外结构域(ectodomain),并在蛋白C端引入了两个脯氨酸突变,以求起到稳定蛋白的作用。先前的论文也表明,这样的做法在同类冠状病毒中确实能起到稳定的效果。
在表达了这些融合前(prefusion)的S蛋白后,利用冷冻电镜技术,科学家们获得了S蛋白的3D结构,分辨率达到了3.5埃(1埃 = 0.1纳米)。对该3D结构的分析发现,其受体结合域(RBD)会上下移动——向上时,S蛋白能够通过这个受体结合域,与细胞表面的受体结合;向下时,与受体结合的部位就会隐藏起来。这有点像我们生活中见到的一些USB盘,只有把接口推出后,才能接到电脑上。
作者们在论文里表示,这种特征同样存在于SARS病毒和MERS病毒中,另外一些亲缘关系较远的冠状病毒里也可以观察到这样的现象。而当S蛋白三聚体的三个受体结合域都向上抬起,与细胞表面的受体结合后,整个S蛋白的结构就会因为不稳定而发生变化。
与SARS病毒S蛋白的异同
最近,不少研究指出新冠病毒所识别的受体可能与SARS病毒一样,都是ACE2。为了评估这种可能性,研究人员们测试了两种病毒与ACE2的结合能力。研究表明,新冠病毒S蛋白膜外结构域与ACE2的亲和力更强,比SARS病毒对应S蛋白区域的结合能力要高出10-20倍。作者们也在论文里提到,这种高亲和力,可能是新冠病毒更容易发生人传人的原因。但他们也强调,这只是一种猜测。为了验证这种猜测的可能性,我们依旧需要更多的研究。
也正是由于和SARS病毒S蛋白的这些相似性,研究人员们进一步评估了能够结合SARS病毒受体结构域的抗体,能否也结合新冠病毒的受体结构域。然而,尽管这两种病毒的受体结合域非常相似,研究中测试的3种针对SARS病毒的抗体,都无法结合新冠病毒的受体结合域。研究人员们在论文里指出,虽然他们测试的抗体只代表了极少的结合表位,但这些结果也表明,针对SARS的单克隆抗体未必对新冠病毒也有活性。因此我们依旧需要基于新冠病毒,开发有效的抗体和其他疗法。
总结
毫无疑问,新冠病毒疫情的快速传播,让疫苗与新药的研发变得迫在眉睫。在论文的最后,作者们指出,清晰到原子水平的S蛋白结构,能够更好地帮助新药研发人员们设计和筛选小分子药物,更精准地指导疫苗设计和抗病毒药物研发,最终加速相应医疗手段的开发进程。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


