Nat Immunol | 南京医科大学王晓明团队合作揭示肿瘤Treg细胞特异性的表观遗传调控机制及靶向新策略
来源:生物世界 2024-02-17 11:05
该研究表明JMJD1C,一种在肿瘤微环境中被细胞因子上调的组蛋白去甲基化酶,对于肿瘤Treg细胞的适应性是必不可少的,但对于全身免疫稳态是可有可无的。
南京医科大学王晓明、中国科学院上海营养与健康研究所秦骏及中国科学院上海药物研究所郑明月共同通讯在Nature Immunology 在线发表题为“Targeting JMJD1C to selectively disrupt tumor Treg cell fitness enhances antitumor immunity”的研究论文,该研究揭示了Treg细胞进入肿瘤组织之后须经历表观遗传的重塑以适应肿瘤恶劣微环境,靶向该重塑过程的关键分子JMJD1C可选择性破坏肿瘤Treg,增强抗肿瘤免疫应答。

Foxp3+ CD4+ Treg细胞对维持免疫耐受和预防自身免疫性疾病至关重要;它们还能浸润肿瘤组织并抑制抗肿瘤免疫。靶向Treg细胞可改善免疫抑制性肿瘤微环境(TME),引发有效的抗肿瘤免疫。然而,Treg细胞的全身性耗竭会扰乱免疫稳态,并可能导致自身免疫性并发症。因此,不影响全身或外周Treg细胞的同时寻找可选择性靶向肿瘤内Treg细胞的调控分子是非常重要的。在这方面,一些分子或途径已被证明对肿瘤内Treg细胞具有特异性。例如,脂质代谢对肿瘤中Treg细胞的维持和功能特别重要,但在炎症环境下则不然。
NRP1, PD1和IL-33信号抑制干扰素γ (IFNγ)的表达以防止肿瘤中的Treg细胞脆性。靶向趋化因子受体CCR8已被证明可以特异性去除肿瘤中克隆扩增的Treg细胞。TME创造了一个特殊的生态位,与稳定或炎症环境不同。需要进一步的研究来确定Treg细胞是否获得新的特征,以确保“适应性”,并在渗透到TME后保持生存、扩展和正常功能的能力。
表观遗传调控已被证明对细胞分化和功能至关重要,包括Treg细胞。CNS2位点适当的DNA甲基化对Foxp3表达和Treg细胞鉴定至关重要。MLL4通过染色质环调控Foxp3的诱导。据报道,Ezh2在细胞激活过程中维持Treg细胞的身份是必需的。然而,目前尚不清楚是否存在对肿瘤内Treg细胞重要而对外周Treg细胞不重要的表观遗传调控机制。考虑到表观遗传调节剂—尤其是酶,包括书写和擦除—可以被小化合物靶向,鉴定肿瘤Treg细胞特异性表观遗传调节剂是很重要的。

在缺乏JMJD1C的情况下,IFNγ缺失可挽救肿瘤Treg细胞的脆弱性(Credit: Nature Immunology)
该研究表明JMJD1C,一种在肿瘤微环境中被细胞因子上调的组蛋白去甲基化酶,对于肿瘤Treg细胞的适应性是必不可少的,但对于全身免疫稳态是可有可无的。JMJD1C缺失以依赖于组蛋白H3赖氨酸9二甲基化(H3K9me2)去甲基化酶和独立于H3K9me2去甲基化酶的STAT3信号的方式增强AKT信号,导致干扰素-γ的强烈产生和肿瘤Treg细胞的脆弱性。研究人员还开发了一种口服JMJD1C抑制剂,通过靶向肿瘤内Treg细胞来抑制肿瘤生长。JMJD1C是一个表观遗传枢纽,可以整合信号以建立肿瘤Treg细胞适应性,并且研究人员提出了一种特异性的JMJD1C抑制剂,可以靶向肿瘤Treg细胞而不影响全身免疫稳态。
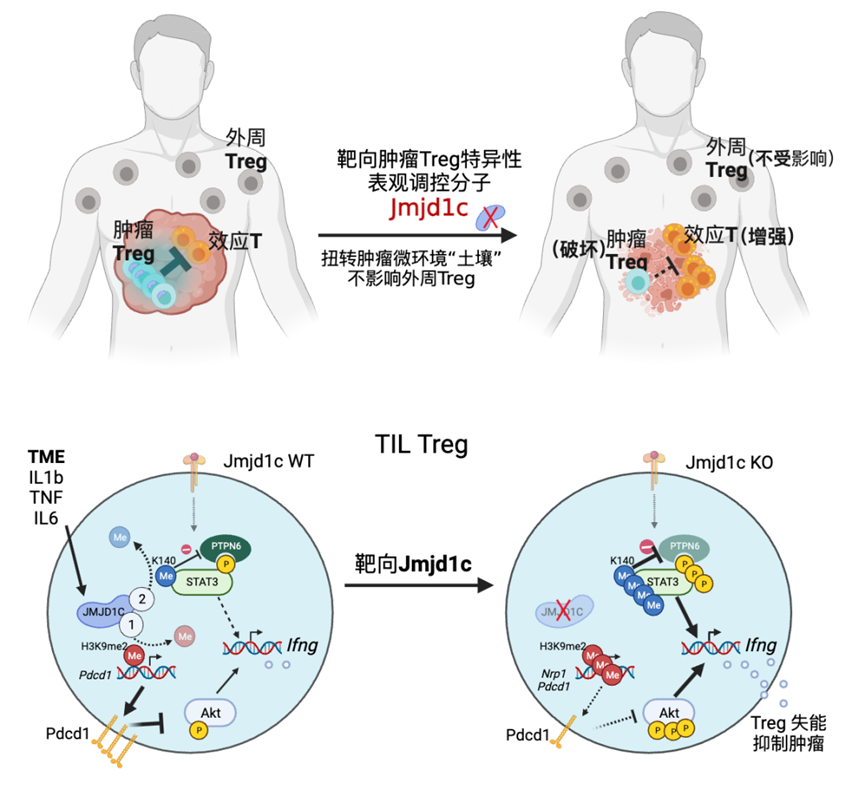
模式图(Credit: Nature Immunology)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


