揭开EGFR、m6A修饰和铁死亡的关联,为胶质瘤联合治疗开辟新道路
来源:生物世界 2023-11-27 09:41
该研究表明,EGFR通过m6A去甲基化酶ALKBH5的细胞核定位,重编程表观转录组图谱,以防止铁死亡,进而揭示了EGFR信号、m6A修饰和铁死亡之间的联系,为胶质母细胞瘤的联合治疗开辟了道路。
匹茨堡大学的研究人员在 Molecular Cell 期刊发表了题为:EGFR promotes ALKBH5 nuclear retention to attenuate N6-methyladenosine and protect against ferroptosis in glioblastoma 的研究论文。
该研究发现,EGFR通过促进m6A去甲基转移酶ALKBH5的细胞核定位,下调m6A水平并保护胶质母细胞瘤细胞免受铁死亡。
该研究揭示了EGFR信号、m6A修饰和铁死亡之间的联系,为胶质母细胞瘤的联合治疗开辟了道路。

转录后RNA修饰是胶质母细胞瘤在表观遗传水平的调控。N6-甲基腺嘌呤(m6A)是真核生物的mRNA和非编码RNA上最丰富的化学修饰类型,m6A受甲基转移酶“书写器”(例如METTL3和METTL16)、去甲基化酶“擦除器”(例如FTO和ALKBH5)和“阅读器”(例如YTHDC1/2、YTHDF1/2/3、IGF2BP1/2/3)的调控,m6A对RNA代谢有重要影响,并涉及癌症在内的一系列生理和疾病过程。
分子表观转录组调节因子在癌症生物学中发挥着复杂作用。METTL3已被报道既是一种致癌基因,又是胶质母细胞瘤的肿瘤抑制因子,而药理学METTL3抑制剂显示出抗肿瘤疗效。去甲基化酶(包括FTO和ALKBH5),也有助于肿瘤生长。由于甲基转移酶和去甲基化酶都促进胶质母细胞瘤生长,m6A水平不仅仅是开关,而是基于下游靶向RNA有助于肿瘤生长。血小板衍生生长因子受体(PDGFR)通过转录调控METTL3来调节线粒体自噬(mitophagy),从而增加胶质母细胞瘤干细胞(GSC)中的m6A丰度。
在这项研究中,研究团队探索了表皮生长因子受体(EGFR)信号在GSC中的作用。与PDGF作用相反,EGFR信号抑制了GSC中的m6A丰度,而基因或药物靶向EGFR提高了m6A水平。
但EGFR没有改变m6A写入或擦除的水平,而是调控了m6A去甲基化酶ALKBH5的磷酸化和核定位。具体来说,激活的EGFR通过诱导非受体酪氨酸激酶SRC来磷酸化修ALKBH5,从而抑制CRM1介导的ALKBH5的核输出,允许细胞核内持续的mRNA的m6A去甲基化。
ALKBH5通过m6A调节和YTHDF2介导的谷氨酸-半胱氨酸连接酶修饰亚基(GCLM)衰老来关键调节铁死亡,GCLM是谷胱甘肽(GSH)生产的一个限速步骤。
铁死亡(Ferroptosis)是2012年发现并定义的一种新型细胞程序性死亡方式,由过度堆积的过氧化脂质(peroxidized lipids)诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。而细胞也有多个对抗铁死亡的防御途径,其中主要是由谷胱甘肽过氧化物酶4(GPX4)介导的,通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡的发生。
通过药物靶向ALKBH5,增强了EGFR和GCLM抑制剂的抗肿瘤效果,这些发现支持EGFR-ALKBH5-GCLM的致癌信号轴。
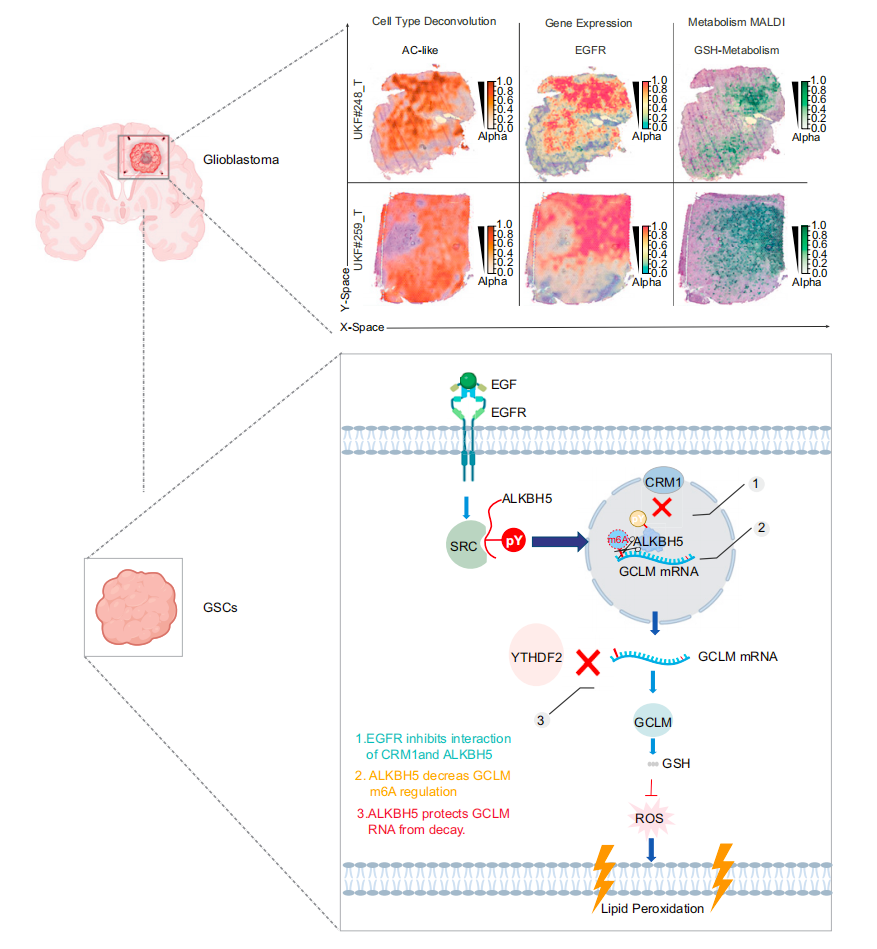
总的来说,该研究表明,EGFR通过m6A去甲基化酶ALKBH5的细胞核定位,重编程表观转录组图谱,以防止铁死亡,进而揭示了EGFR信号、m6A修饰和铁死亡之间的联系,为胶质母细胞瘤的联合治疗开辟了道路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


