Nat Metab:新研究指出铁死亡与炎症性肠病相关联
来源:生物谷原创 2025-06-28 13:39
在IBD模型小鼠中进行的精心实验证实,成纤维细胞(构成结缔组织的细胞)中过表达的ACSL4酶似乎驱动了结肠内壁中脂质ROS的生成和细胞死亡。
炎症性肠病(IBD)包括溃疡性结肠炎和克罗恩病。许多IBD患者的生活质量受到影响,他们常遭受慢性腹泻、疼痛和疲劳的困扰。IBD的一个病理学特征是发炎的大肠组织的细胞中活性氧(ROS)的增加。
尽管ROS是代谢的正常副产物(且随年龄增长而积累),但过量ROS会导致细胞损伤并引发疾病。这一看似确凿的证据促使人们探索抗氧化剂作为IBD的潜在治疗手段,因为它们可中和ROS。事实上,抗氧化剂已在急性IBD动物模型中成功缓解了疾病症状。

然而,针对人体中抑制ROS的药物的临床试验并未取得成功。在一项新的研究中,密歇根大学医学院生理学讲席教授Yatrik Shah博士及其团队指出过量抗氧化剂可能引发还原应激,导致细胞功能障碍、细胞死亡,并阻断对细胞中正常功能至关重要的信号传导事件。相关研究结果发表在Nature Metabolism杂志上。
Shah实验室致力于构建更优的动物模型,以更准确地反映IBD的慢性特性。此外,他们还对与IBD相关的细胞内活性氧进行了深入研究。Shah实验室的两名研究生,Wesley Huang博士和Yuezhong “Diana” Zhang,设计了一种方法,可在慢性IBD小鼠模型以及密歇根大学胃肠病学与肝病学科的Peter Higgins博士提供的患者样本中测量这些短寿命分子。他们发现,一种与脂质相关的特定类型活性氧存在于肠道上皮细胞中。
脂质ROS会激活一种相对较新发现的依赖于铁的细胞死亡类型,称为铁死亡(ferroptosis)。这进一步提示着铁死亡与IBD之间的关联,Shah实验室通过分析IBD组织中的RNA表达数据,发现IBD组织和非IBD组织中与铁死亡相关的基因表达存在差异——特别是一个名为ACSL4的基因。
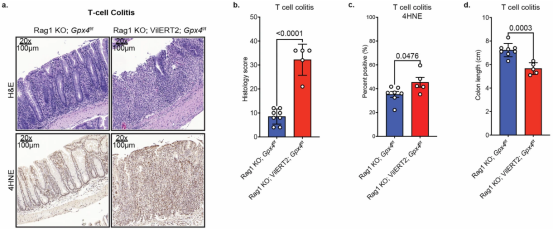
在IBD模型小鼠中进行的精心实验证实,成纤维细胞(构成结缔组织的细胞)中过表达的ACSL4酶似乎驱动了结肠内壁中脂质ROS的生成和细胞死亡。
Zhang指出,正常小鼠并未观察到脂质ROS诱导的铁死亡效应,这提示着在IBD病例中可能存在其他机制。然而,这一关联的发现为克罗恩病和结肠炎的药物靶点提供了新方向。
Shah说道,“如果这是驱动IBD炎症性质的主要特征,并且是导致这种疾病恶化的因素,那么我们可以特异性地靶向它。无需靶向所有活性氧,我们只需抑制一种与铁死亡相关的活性氧。”
例如,一种抑制铁死亡的药物在小鼠模型中缓解了部分症状,而ACSL4可能成为治疗IBD的新型靶点。(生物谷Bioon.com)
参考文献:
Wesley Huang et al, Fibroblast lipid metabolism through ACSL4 regulates epithelial sensitivity to ferroptosis in IBD, Nature Metabolism (2025). DOI: 10.1038/s42255-025-01313-x.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


