广州医科大学×广州国家实验室发表最新Cell论文
来源:生物世界 2025-08-09 11:26
该研究使用化学小分子将小鼠胚胎干细胞诱导转化为新型的类全能干细胞——“胚胎始源细胞” 。
胚胎模型为理解发育过程和推动医学进步提供了机会,但其依赖复杂的程序,且在效率和发育的准确性方面存在局限性。
2025 年 8 月 7 日,广州医科大学附属第一医院/广州国家实验室 José Silva/李欢欢团队与广州国家实验室景乃禾团队合作(李欢欢、关炜、黄嘉慧、沈朋雷为共同第一作者),在国际顶尖学术期刊 Cell 上发表题为:A Complete Model of Mouse Embryogenesis Through Organogenesis Enabled by Chemically Induced Embryo Founder Cells 的研究论文。
该研究使用化学小分子将小鼠胚胎干细胞诱导转化为新型的类全能干细胞——“胚胎始源细胞” (embryonic founder cell,EFC),该细胞能够独立启动并有序完成胚胎发育,首次实现了从 8-16 细胞到谱系特化、原肠运动,至早期器官发生的体外胚胎重构的全过程。这一创新模型不仅模拟了小鼠胚胎早期多胚层协同发育的复杂过程,更突破了转基因依赖和多系混合的限制,为器官发生发育、疾病机制及再生医学的研究提供了新的方案和革命性工具。

在这项最新研究中,研究团队采用仅使用化学小分子(CHIR-99021、E-616452、Lif、AM580)的方法,将小鼠胚胎干细胞诱导为 8-16 细胞期的“胚胎始源细胞” (embryonic founder cell,EFC),进而能够生成完整的胚胎模型。
这些 EFC 细胞在体内和体外均能确定所有囊胚的谱系,包括胚胎谱系和额外胚层谱系。仅由 EFC 细胞构建的胚胎模型能够真实地再现从器官形成开始的发育过程。在原肠胚形成过程中,它通过上皮细胞向间充质细胞的转化形成原条,生成内-中-外三个胚层,并发育出外胚层胎盘锥。该模型接着形成 6-14 对体节、前脑/中脑/后脑、弯曲的心管、眼泡、尿囊、尾芽、迁移的原始生殖细胞等早期器官雏形以及结构清晰的肠道。
该研究的亮点:
-
小分子将胚胎干细胞转化为诱导的 8-16 细胞样胚胎始源细胞(iEFC);
-
iEFC 能够在体内和体外指定所有囊胚的谱系;
-
iEFC 生成了一种直接、快速、高效、可扩展且忠实的胚胎模型(iEFC-EM);
-
iEFC-EM 在体外重现了小鼠胚胎发育过程,直至器官形成阶段。
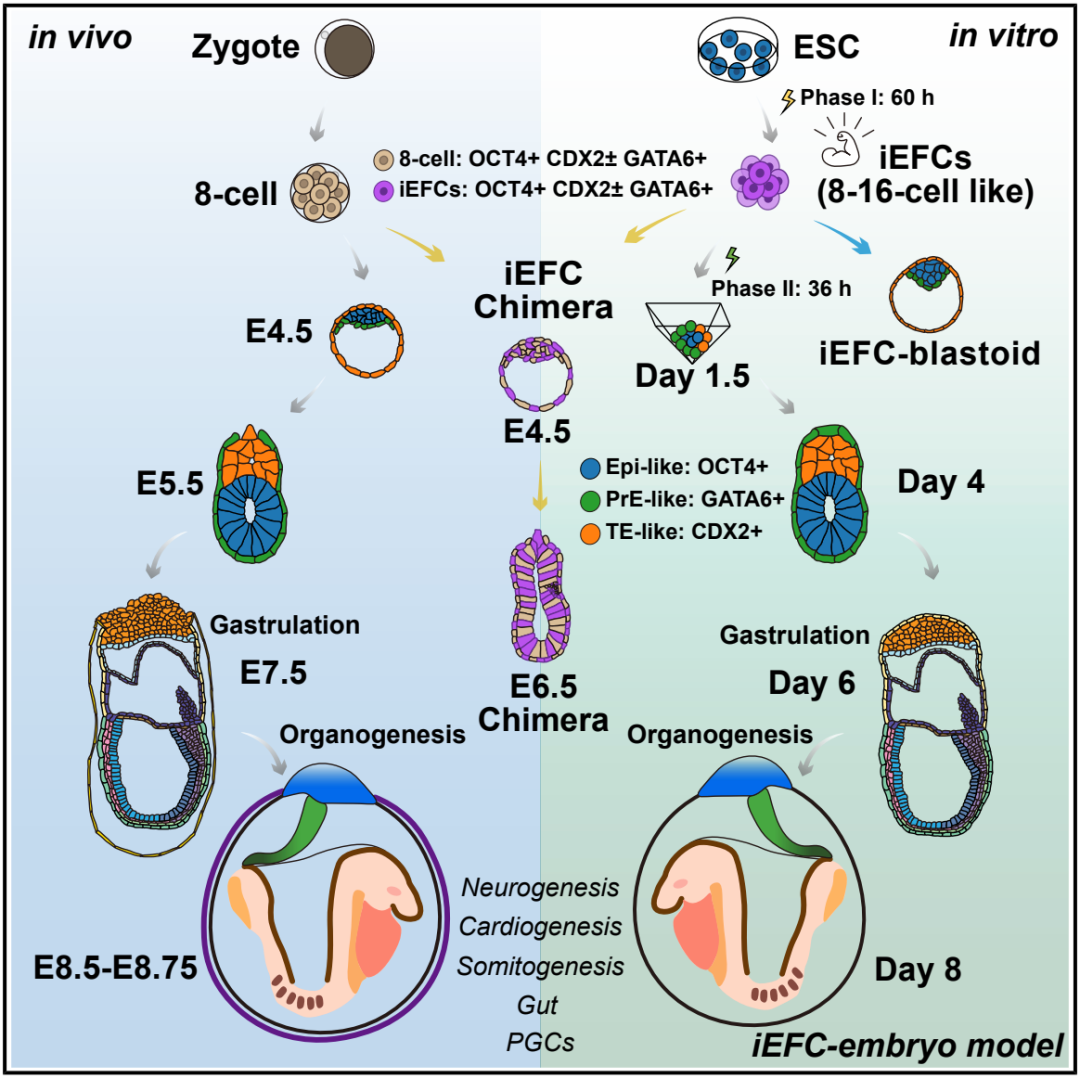
总的来说,该研究利用胚胎始源细胞的系统能够直接、快速、高效且准确地构建胚胎发育的体外模型。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


