PNAS:揭示HIV成功逃避ZAP蛋白捕捉之谜
来源:本站原创 2019-12-16 19:49
2019年12月14日讯/生物谷BIOON/---人类进化出了抵抗试图感染我们身体的病毒的动态防御机制,即专门识别、捕获和破坏病毒试图嵌入我们细胞中的遗传物质的蛋白。在一项新的研究中,来自美国密歇根大学和洛克菲勒大学的研究人员如今揭示了这些蛋白中的一种称为ZAP的蛋白(zinc-finger antiviral protein, 锌指抗病毒蛋白)如何捕捉外来
2019年12月16日讯/生物谷BIOON/---人类进化出了抵抗试图感染我们身体的病毒的动态防御机制,即专门识别、捕获和破坏病毒试图导入到我们细胞中的遗传物质的蛋白。
在一项新的研究中,来自美国密歇根大学和洛克菲勒大学的研究人员如今揭示了这些蛋白中的一种称为ZAP的蛋白(zinc-finger antiviral protein, 锌指抗病毒蛋白)如何捕捉外来入侵者,而且还揭示了包括人类免疫缺陷病毒(HIV)在内的一些病毒如何逃避这种捕捉。揭示让这种蛋白在某些情况下成为一种有效的抗病毒试剂的确切机制是在开发更好地攻击试图逃避它的病毒的方法的目标上迈出关键的第一步。相关研究结果近期发表在PNAS期刊上,论文标题为“Structure of the zinc-finger antiviral protein in complex with RNA reveals a mechanism for selective targeting of CG-rich viral sequences”。
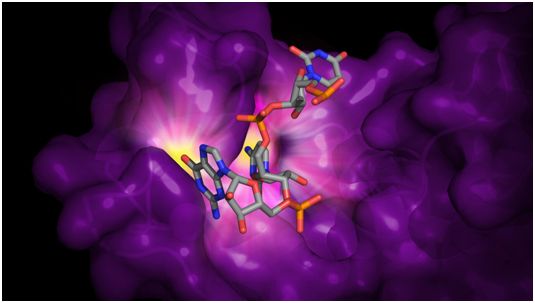
ZAP蛋白是由细胞产生的,用以限制病毒复制和传播感染。当细胞检测到病毒时,编码ZAP的基因就会开启并产生更多的ZAP蛋白。ZAP蛋白随后将病毒的RNA与细胞自己的RNA区分开来,从而使得病毒RNA随后遭受破坏。
洛克菲勒大学先前的一项研究已表明,ZAP仅捕获含有CG二核苷酸的RNA序列。人类的RNA几乎没有CG二核苷酸,HIV RNA经过进化后也模拟这种特征。
论文共同第一作者、密歇根大学生命科学研究所研究员Jennifer Meagher说,“这项研究的主要动机是‘HIV如何逃避这种抗病毒蛋白的捕获?’鉴于我们是结构生物学者,我们想要确定ZAP如何‘看见’CG二核苷酸,以及在结构上如何结合含有CG二核苷酸的RNA。”
通过使用经过基因改造后含有额外CG序列的病毒RNA片段,Meagher及其在密歇根大学的同事们解析出ZAP蛋白与这种RNA片段结合在一起时的三维结构,从而揭示出让这种蛋白具有如此高选择性的机制。
这些研究人员发现ZAP仅在这种蛋白的4个他们认为是潜在结合位点的“锌指”结构之一上与这种病毒RNA结合。他们进一步证实即使对这种结合位点进行微小的改变(仅改变单个原子),也会破坏ZAP的结合能力。
在细胞中开展实验时,论文共同通讯作者、洛克菲勒大学逆转录病毒实验室主任Paul Bieniasz及其同事们在改变ZAP的组成时也取得了类似的结果。他们构建出在受到正常HIV或富含CG序列的HIV变体感染的细胞中表达的ZAP突变体。
这些突变的ZAP蛋白不太能够识别细胞中病毒RNA的富含CG的区域。它们还显示出对CG二核苷酸含量不高的RNA区域的结合增加,这表明这些突变会破坏ZAP区分病毒RNA与人类RNA的能力。
Bieniasz说:“自然选择似乎已经以根据CG二核苷酸含量优化区分非自我RNA和自我RNA的方式塑造了ZAP蛋白结构。但是,成功存活下来的病毒通常在这种分子军备竞赛中领先一步。”
论文共同通讯作者、密歇根大学医学院生物化学教授Janet Smith说,“这是细胞最终如何降解病毒RNA这个复杂故事的关键的第一步。如今,我们知道这一步骤是如何执行的,以及为何它无法有效地捕捉缺乏CG序列的HIV和其他病毒。”(生物谷 Bioon.com)
参考资料:
1.Jennifer L. Meagher el al. Structure of the zinc-finger antiviral protein in complex with RNA reveals a mechanism for selective targeting of CG-rich viral sequences. PNAS, 2019, doi:10.1073/pnas.1913232116.
2.New research explains how HIV avoids getting ZAPped
https://phys.org/news/2019-11-hiv-zapped.html
在一项新的研究中,来自美国密歇根大学和洛克菲勒大学的研究人员如今揭示了这些蛋白中的一种称为ZAP的蛋白(zinc-finger antiviral protein, 锌指抗病毒蛋白)如何捕捉外来入侵者,而且还揭示了包括人类免疫缺陷病毒(HIV)在内的一些病毒如何逃避这种捕捉。揭示让这种蛋白在某些情况下成为一种有效的抗病毒试剂的确切机制是在开发更好地攻击试图逃避它的病毒的方法的目标上迈出关键的第一步。相关研究结果近期发表在PNAS期刊上,论文标题为“Structure of the zinc-finger antiviral protein in complex with RNA reveals a mechanism for selective targeting of CG-rich viral sequences”。

与ZAP蛋白结合在一起的RNA示意图。ZAP结合到病毒RNA中的胞嘧啶(C)/鸟嘌呤(G)二核苷酸(CG二核苷酸)上,以阻止病毒复制和扩散感染。这种特定的胞嘧啶和鸟嘌呤位点用黄色高亮显示。图片来自Rajani Aroroa, U-M Life Sciences Institute。
洛克菲勒大学先前的一项研究已表明,ZAP仅捕获含有CG二核苷酸的RNA序列。人类的RNA几乎没有CG二核苷酸,HIV RNA经过进化后也模拟这种特征。
论文共同第一作者、密歇根大学生命科学研究所研究员Jennifer Meagher说,“这项研究的主要动机是‘HIV如何逃避这种抗病毒蛋白的捕获?’鉴于我们是结构生物学者,我们想要确定ZAP如何‘看见’CG二核苷酸,以及在结构上如何结合含有CG二核苷酸的RNA。”
通过使用经过基因改造后含有额外CG序列的病毒RNA片段,Meagher及其在密歇根大学的同事们解析出ZAP蛋白与这种RNA片段结合在一起时的三维结构,从而揭示出让这种蛋白具有如此高选择性的机制。
这些研究人员发现ZAP仅在这种蛋白的4个他们认为是潜在结合位点的“锌指”结构之一上与这种病毒RNA结合。他们进一步证实即使对这种结合位点进行微小的改变(仅改变单个原子),也会破坏ZAP的结合能力。
在细胞中开展实验时,论文共同通讯作者、洛克菲勒大学逆转录病毒实验室主任Paul Bieniasz及其同事们在改变ZAP的组成时也取得了类似的结果。他们构建出在受到正常HIV或富含CG序列的HIV变体感染的细胞中表达的ZAP突变体。
这些突变的ZAP蛋白不太能够识别细胞中病毒RNA的富含CG的区域。它们还显示出对CG二核苷酸含量不高的RNA区域的结合增加,这表明这些突变会破坏ZAP区分病毒RNA与人类RNA的能力。
Bieniasz说:“自然选择似乎已经以根据CG二核苷酸含量优化区分非自我RNA和自我RNA的方式塑造了ZAP蛋白结构。但是,成功存活下来的病毒通常在这种分子军备竞赛中领先一步。”
论文共同通讯作者、密歇根大学医学院生物化学教授Janet Smith说,“这是细胞最终如何降解病毒RNA这个复杂故事的关键的第一步。如今,我们知道这一步骤是如何执行的,以及为何它无法有效地捕捉缺乏CG序列的HIV和其他病毒。”(生物谷 Bioon.com)
参考资料:
1.Jennifer L. Meagher el al. Structure of the zinc-finger antiviral protein in complex with RNA reveals a mechanism for selective targeting of CG-rich viral sequences. PNAS, 2019, doi:10.1073/pnas.1913232116.
2.New research explains how HIV avoids getting ZAPped
https://phys.org/news/2019-11-hiv-zapped.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


