Cell子刊详解SARS-CoV-2刺突蛋白中的多精氨酸切割位点是感染人类肺细胞的关键
来源:本站原创 2020-04-26 20:40
2020年4月26日讯/生物谷BIOON/---人们认为新型冠状病毒SARS-CoV-2(以前称为2019-nCoV)是在2019年末从一种特征不明显的动物宿主传播到人类。随后,SARS-CoV-2传播的震中是中国湖北省武汉市,超过65000例病例发生在该地区。然而,目前已经在110多个国家发现了感染病例,美国、意大利和西班牙目前正在大规模爆发疫情。了解SA
2020年4月26日讯/生物谷BIOON/---人们认为新型冠状病毒SARS-CoV-2(以前称为2019-nCoV)是在2019年末从一种特征不明显的动物宿主传播到人类。随后,SARS-CoV-2传播的震中是中国湖北省武汉市,超过65000例病例发生在该地区。然而,目前已经在110多个国家发现了感染病例,美国、意大利和西班牙目前正在大规模爆发疫情。了解SARS-CoV-2的哪些特征是它感染人体细胞所必需的,应当能够提供对病毒传播性和发病机制的新见解,并可能揭示出进行干预的靶标。
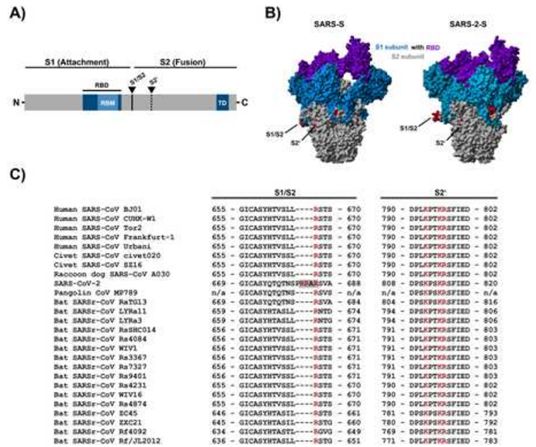
冠状病毒的刺突蛋白(S)被整合到病毒包膜中,促进病毒进入靶细胞。为此,S蛋白的表面单元S1与细胞受体结合,而它的跨膜单元S2促进病毒包膜与细胞膜融合。膜融合依赖于宿主细胞蛋白酶在S1/S2和S2′位点对S蛋白进行切割(图1A),从而导致S蛋白激活。S蛋白切割可以发生在受感染细胞的构成性分泌途径中,也可以发生在病毒进入靶细胞的过程中,对病毒感染性至关重要。因此,负责这种切割的酶构成了抗病毒干预的潜在靶点。
之前的研究已显示揭示可激活多种冠状病毒的细胞丝氨酸蛋白酶TMPRSS2的活性也是SARS-CoV-2强劲感染人肺细胞所必需的。
然而,可以想象,其他细胞蛋白酶的活性也是必要的。因此,中东呼吸综合征(MERS)冠状病毒(MERS-CoV)刺突蛋白(MERS-S)通过两个步骤激活:在受感染细胞中,MERS-S在S1/S2位点首先被弗林蛋白酶(furin)切割,这是随后在病毒进入肺细胞过程中,MERS-S在S2'位点上遭受TMPRSS2介导的切割所需的(图1A)。一种组织蛋白酶B/L(cathepsin B/L)依赖性的辅助激活途径在许多TMPRSS2阴性细胞系中发挥作用,但在肺部的病毒靶细胞中似乎不存在,这是因为TMPRSS2依赖性的S蛋白激活对于MERS-CoV和SARS-CoV在感染宿主中的强健传播和发病是必不可少的。
SARS-CoV-2中的S1/S2位点形成了一个暴露的环(图1B),这种暴露环携带着多个精氨酸残基(multibasic),这多个精氨酸残基在SARS-CoV相关的冠状病毒(SARSr-CoV)中没有发现,但在人类冠状病毒OC43、HKU1和MERS-CoV中存在(图1C)。然而,这个多精氨酸切割位点对SARS-CoV-2感染人细胞的贡献是未知的。
在一项新的研究中,来自德国哥廷根大学和德国灵长类动物中心-莱布尼兹灵长类动物研究所的研究人员针对这一点进行了探究。相关研究结果以论文手稿的形式在线发表在Molecular Cell期刊上,论文标题为“A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells”。
这些研究人员发现弗林蛋白酶在S1/S2位点上切割S蛋白,而且这种切割对于S蛋白介导的细胞-细胞融合和人肺细胞进入至关重要。此外,优化S1/S2位点可增加细胞-细胞融合,但不增加病毒-细胞融合,这表明相应的病毒变体可能表现出增加的细胞-细胞传播和潜在的毒力改变。这些研究结果表明S1/S2多精氨酸切割位点的获得对于SARS-CoV-2感染人类来说是至关重要的,并确定了弗林蛋白酶作为治疗干预的潜在靶点。
这些研究人员揭示了SARS-CoV-2和MERS-CoV的蛋白酶解激活之间的共同点。这两种病毒都依赖于弗林蛋白酶介导的S蛋白在S1/S2位点上的事先切割,以便S蛋白随后在不能强劲表达组织蛋白酶L的肺细胞中被TMPRSS2激活。因此,针对弗林蛋白酶和TMPRSS2的抑制剂可能被认为是COVID-19的治疗选择,而且近期人们已经描述了一种TMPRSS2抑制剂可阻断SARS-CoV-2感染。关于弗林蛋白酶抑制,必须考虑到与TMPRSS2不同的是,弗林蛋白酶是正常发育所需的。因此,对这种酶的长期阻断可能与意想不到的毒性作用有关。相比之下,短暂的治疗可能会有很好的耐受性,并且仍然具有治疗作用。
对于甲型禽流感病毒来说,病毒血凝素蛋白中的多精氨酸切割位点是这种病毒的核心毒力因子。因此,具有单精氨酸切割位点的病毒可被TMPRSS2或相关蛋白酶激活,其表达谱局限于上呼吸消化道。因此,病毒的复制仅限于这些器官,不会导致严重的疾病。相反之下,具有多精氨酸切割位点的病毒可被广泛表达的前蛋白转化酶(包括弗林蛋白酶)激活,因此可以进行全身性传播并导致大规模疾病。在冠状病毒感染的背景下,S蛋白的可切割性已被确定为人畜共患病的一个决定因素。因此,SARS-CoV-2 S蛋白(SARS-2-S)中存在一个高度可切割的S1/S2位点可能并不意外。
然而,值得注意的是,目前在蝙蝠和穿山甲中发现的所有SARS-CoV-2相关冠状病毒都含有一个单精氨酸切割位点。因此,确定SARS-CoV-2如何获得这个多精氨酸基序将是一件有趣的事情,而且近期的一项研究提出重组事件可能是原因之一。
总之,这些研究结果表明多精氨酸S1/S2切割位点是SARS-2-S驱动的TMPRSS2阳性肺细胞进入是必不可少的。把这些研究拓展到原代人类呼吸道上皮细胞和真正的SARS-CoV-2将是非常有趣的,这需要一种反向遗传学系统,而这项新的研究尚不具备这样的反向遗传学系统。(生物谷 Bioon.com)
参考资料:
Markus Hoffmann et al. A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells. Molecular Cell, 2020, doi:10.1016/j.molcel.2020.04.022.
冠状病毒的刺突蛋白(S)被整合到病毒包膜中,促进病毒进入靶细胞。为此,S蛋白的表面单元S1与细胞受体结合,而它的跨膜单元S2促进病毒包膜与细胞膜融合。膜融合依赖于宿主细胞蛋白酶在S1/S2和S2′位点对S蛋白进行切割(图1A),从而导致S蛋白激活。S蛋白切割可以发生在受感染细胞的构成性分泌途径中,也可以发生在病毒进入靶细胞的过程中,对病毒感染性至关重要。因此,负责这种切割的酶构成了抗病毒干预的潜在靶点。
之前的研究已显示揭示可激活多种冠状病毒的细胞丝氨酸蛋白酶TMPRSS2的活性也是SARS-CoV-2强劲感染人肺细胞所必需的。
然而,可以想象,其他细胞蛋白酶的活性也是必要的。因此,中东呼吸综合征(MERS)冠状病毒(MERS-CoV)刺突蛋白(MERS-S)通过两个步骤激活:在受感染细胞中,MERS-S在S1/S2位点首先被弗林蛋白酶(furin)切割,这是随后在病毒进入肺细胞过程中,MERS-S在S2'位点上遭受TMPRSS2介导的切割所需的(图1A)。一种组织蛋白酶B/L(cathepsin B/L)依赖性的辅助激活途径在许多TMPRSS2阴性细胞系中发挥作用,但在肺部的病毒靶细胞中似乎不存在,这是因为TMPRSS2依赖性的S蛋白激活对于MERS-CoV和SARS-CoV在感染宿主中的强健传播和发病是必不可少的。
SARS-CoV-2中的S1/S2位点形成了一个暴露的环(图1B),这种暴露环携带着多个精氨酸残基(multibasic),这多个精氨酸残基在SARS-CoV相关的冠状病毒(SARSr-CoV)中没有发现,但在人类冠状病毒OC43、HKU1和MERS-CoV中存在(图1C)。然而,这个多精氨酸切割位点对SARS-CoV-2感染人细胞的贡献是未知的。

图1.图片来自Molecular Cell, 2020, doi:10.1016/j.molcel.2020.04.022。
在一项新的研究中,来自德国哥廷根大学和德国灵长类动物中心-莱布尼兹灵长类动物研究所的研究人员针对这一点进行了探究。相关研究结果以论文手稿的形式在线发表在Molecular Cell期刊上,论文标题为“A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells”。
这些研究人员发现弗林蛋白酶在S1/S2位点上切割S蛋白,而且这种切割对于S蛋白介导的细胞-细胞融合和人肺细胞进入至关重要。此外,优化S1/S2位点可增加细胞-细胞融合,但不增加病毒-细胞融合,这表明相应的病毒变体可能表现出增加的细胞-细胞传播和潜在的毒力改变。这些研究结果表明S1/S2多精氨酸切割位点的获得对于SARS-CoV-2感染人类来说是至关重要的,并确定了弗林蛋白酶作为治疗干预的潜在靶点。
这些研究人员揭示了SARS-CoV-2和MERS-CoV的蛋白酶解激活之间的共同点。这两种病毒都依赖于弗林蛋白酶介导的S蛋白在S1/S2位点上的事先切割,以便S蛋白随后在不能强劲表达组织蛋白酶L的肺细胞中被TMPRSS2激活。因此,针对弗林蛋白酶和TMPRSS2的抑制剂可能被认为是COVID-19的治疗选择,而且近期人们已经描述了一种TMPRSS2抑制剂可阻断SARS-CoV-2感染。关于弗林蛋白酶抑制,必须考虑到与TMPRSS2不同的是,弗林蛋白酶是正常发育所需的。因此,对这种酶的长期阻断可能与意想不到的毒性作用有关。相比之下,短暂的治疗可能会有很好的耐受性,并且仍然具有治疗作用。
对于甲型禽流感病毒来说,病毒血凝素蛋白中的多精氨酸切割位点是这种病毒的核心毒力因子。因此,具有单精氨酸切割位点的病毒可被TMPRSS2或相关蛋白酶激活,其表达谱局限于上呼吸消化道。因此,病毒的复制仅限于这些器官,不会导致严重的疾病。相反之下,具有多精氨酸切割位点的病毒可被广泛表达的前蛋白转化酶(包括弗林蛋白酶)激活,因此可以进行全身性传播并导致大规模疾病。在冠状病毒感染的背景下,S蛋白的可切割性已被确定为人畜共患病的一个决定因素。因此,SARS-CoV-2 S蛋白(SARS-2-S)中存在一个高度可切割的S1/S2位点可能并不意外。
然而,值得注意的是,目前在蝙蝠和穿山甲中发现的所有SARS-CoV-2相关冠状病毒都含有一个单精氨酸切割位点。因此,确定SARS-CoV-2如何获得这个多精氨酸基序将是一件有趣的事情,而且近期的一项研究提出重组事件可能是原因之一。
总之,这些研究结果表明多精氨酸S1/S2切割位点是SARS-2-S驱动的TMPRSS2阳性肺细胞进入是必不可少的。把这些研究拓展到原代人类呼吸道上皮细胞和真正的SARS-CoV-2将是非常有趣的,这需要一种反向遗传学系统,而这项新的研究尚不具备这样的反向遗传学系统。(生物谷 Bioon.com)
参考资料:
Markus Hoffmann et al. A multibasic cleavage site in the spike protein of SARS-CoV-2 is essential for infection of human lung cells. Molecular Cell, 2020, doi:10.1016/j.molcel.2020.04.022.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


