上海交通大学的研究者们揭示了胃癌相关成纤维细胞通过铁调控诱导铁死亡
来源:生物谷原创 2023-10-24 18:44
胃癌(GC)是一种原发性恶性肿瘤,在全球范围内造成重大健康负担,是2020年癌症相关死亡的第四大原因。新辅助放化疗和胃癌根治术是该疾病的主要治疗方法,但是由于转移和复发,不可切除胃癌患者的总体预后不佳
胃癌(GC)是一种原发性恶性肿瘤,在全球范围内造成重大健康负担,是2020年癌症相关死亡的第四大原因。新辅助放化疗和胃癌根治术是该疾病的主要治疗方法,但是由于转移和复发,不可切除胃癌患者的总体预后不佳。因此,阐明GC进展的潜在机制和确定新的治疗策略是当务之急。

图片来源:https://doi.org/10.1016/j.redox.2023.102923
近日,来自上海交通大学的研究者们在Redox Biol.杂志上发表了题为“Cancer-associated fibroblasts impair the cytotoxic function of NK cells in gastric cancer by inducing ferroptosis via iron regulation”的文章,本研究证明了癌症相关成纤维细胞(CAFs)在肿瘤微环境(TME)中抑制NK细胞活性的新机制,并提出了一种增强NK细胞介导的GC免疫反应的潜在治疗方法。
作为TME中主要的免疫抑制成分,癌症相关成纤维细胞(CAFs)抑制自然杀伤细胞(NK细胞)活性,促进肿瘤进展和免疫逃逸;然而,对癌症(GC)中CAFs和NK细胞之间的串扰机制仍知之甚少。
在这项研究中,研究者证明了NK细胞水平与人类GC中的CAFs丰度呈负相关。CAFs通过诱导铁死亡损害NK细胞的抗肿瘤能力,铁死亡是一种以铁依赖性脂质过氧化物积累为特征的细胞死亡过程。CAFs通过促进铁过载诱导NK细胞铁凋亡;相反,细胞内铁水平降低可保护NK细胞免受cafa诱导的铁死亡。从机制上讲,CAFs通过向TME输出铁来增加NK细胞内的不稳定铁池,这是由CAFs中铁调控基因铁转运蛋白1和hephaestin的上调表达介导的。此外,caff衍生的卵泡抑素样蛋白1(FSTL1)通过DIP2A-P38途径上调NK细胞中NCOA4的表达,NCOA4介导的铁蛋白自噬是caff诱导的NK细胞铁死亡所必需的。在人类患者来源的类器官模型中,使用去铁胺和fstl1中和抗体联合靶向CAFs的功能可显著减轻CAFs诱导的NK细胞铁凋亡,并增强NK细胞对GC的细胞毒性。
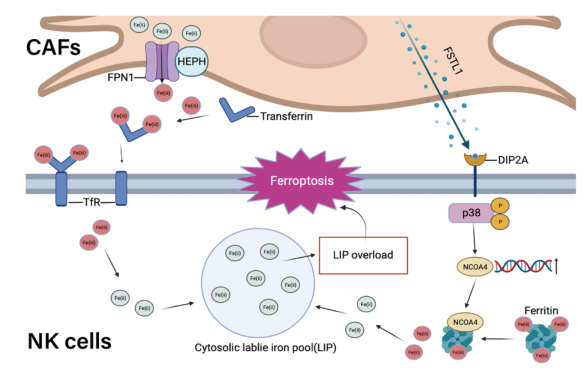
CAFs诱导GC中NK细胞铁死亡的假定机制图。
图片来源:https://doi.org/10.1016/j.redox.2023.102923
综上所述,CAFs通过向TME输出铁,促进fstl1 - ncoa4介导的铁蛋白自噬,从而增加NK细胞内的不稳定铁,诱导铁死亡。该发现强调了靶向这些途径作为增强NK细胞对GC免疫反应的治疗策略的潜力。然而,为了了解TME中CAFs和免疫细胞之间复杂的相互作用,并探索这些发现对胃癌治疗的临床意义,需要进一步的研究。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


