Nature系列综述:mRNA-纳米医学新时代
来源:生物世界 2023-10-07 13:07
这是mRNA疫苗技术和制造的新时代,它是遗传学和纳米医学交叉领域数十年研究进展的丰碑,这一交叉也将作为科学和医学研究中最伟大的成就之一载入史册。
自20世纪90年代初以来,遗传学(Genetics)和纳米医学(Nanomedicine)的交叉已经在临床中找到了一席之地,并成为了过去十年来的游戏规则改变者之一,通过快速开发急需的治疗平台,在对抗从癌症到传染病、遗传疾病等方面拥有巨大希望。
mRNA新冠疫苗的成功开发和广泛接种,为阻止新冠大流行做出了巨大贡献,这是遗传学和纳米医学交叉领域数十年研究进展的一座丰碑,也开启了mRNA疫苗技术和制造的新时代,这一交叉也将作为科学和医学研究中最伟大的成就之一载入史册。

当遗传学与纳米医学相遇
在遗传学的发展史上,有这许多熠熠生辉的科学家的名字。首先是孟德尔,他提出了一个新颖的概念——遗传因子具有颗粒性,这种遗传因子此后被命名为基因(Gene)。二十世纪下半叶,法国遗传学家 Jérôme Lejeune 发现染色体异常导致唐氏综合征,这也开创了医学细胞遗传学。最重要的是,1953年,詹姆斯·沃森、弗朗西斯·克里克以及罗莎琳德·富兰克林发现了DNA双螺旋结构,为遗传学和医学进入分子化时代铺平了道路。
20世纪50年代中期,André Boivin提出了RNA可能参与遗传,并指出“大分子脱氧核糖核酸(DNA)控制着大分子核糖核酸(RNA)的产生,它们一起控制着细胞质中酶的制造。然而,当时缺乏证据支持这一理论,因此很少有人关注这些微妙的RNA分子。
直到1961年,mRNA(信使RNA)被发现,当时 Sydney Brenner 等人发现RNA是一种脆弱的中间分子,可以复制来自DNA的信息并控制蛋白质合成,他们得出结论——稳定的核糖体RNA不包括蛋白质编码信息,遗传密码是由瞬时的mRNA翻译的,核糖体根据mRNA提供的指令制造蛋白质。1969年,Raymond Lockard 和 Jerry Lingrel 合作提出了第一个体外mRNA翻译的证据。
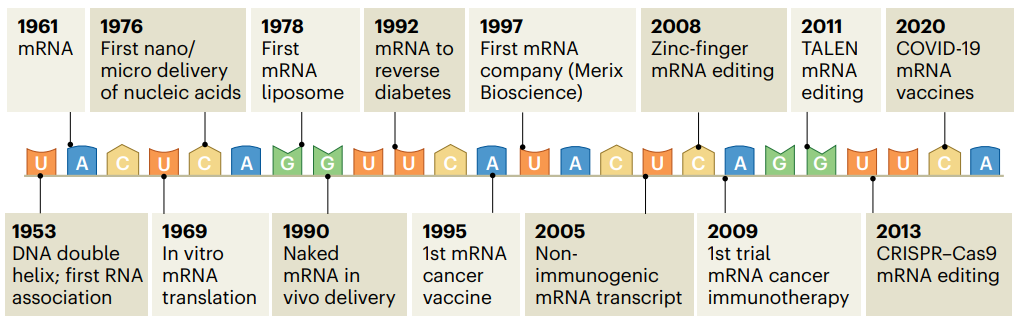
从mRNA的发现到mRNA-纳米医学的到来
1976年,罗伯特·兰格(Robert Langer)在 Nature 发表论文,首次报道了使用纳米颗粒和微颗粒来包装核酸(包括DNA和RNA),这让使用DNA或RNA作为治疗药物成为可能。两年后,首次通过脂质体将mRNA传递给淋巴细胞,这进一步扩展了mRNA技术的应用。
1989年,一种非聚乙二醇化的阳离子脂质体被用于mRNA的递送。1994年,PEG被添加到纳米颗粒表面,以防止其在巨噬细胞和肝细胞的聚集和非特异性摄取。
在这一段时间里,mRNA作为一种可能的治疗方法受到越来越多的关注。1990年,裸mRNA作为一种潜在治疗分子被注射到小鼠肌肉中,这为通过体内表达mRNA作为治疗工具奠定了基础。1992年,Gustav Jirikowski 使用mRNA暂时修复了缺乏抗逆尿激素的大鼠的尿失禁。
虽然mRNA疫苗作为纳米医学的概念相对较新,但它实际上可以追溯到1993年,当时 Frédéric Martinon 等人首次开发了编码流感病毒核蛋白的mRNA的纳米颗粒递送系统。1995年,Robert Conry 等人开发了第一款编码癌症抗原的mRNA疫苗。1997年,第一家mRNA公司 Merix Bioscience 成立。
2005年,Katalin Karikó 和 Drew Weissman 在 Immunity 期刊发表论文,首次报道了对mRNA的核苷进行修饰可以大大减少mRNA引起的免疫反应,还能提高mRNA的翻译效率,这样mRNA疫苗就可以以更高的剂量注射,从而产生更多的抗体反应,而发烧、发冷、疼痛等令人讨厌的副作用则更少。

Drew Weissman(左)和Katalin Karikó(右)
2008年-2013年,基于RNA的基因编辑工具,ZFN、TALEN以及CRSIPR被陆续开发出来。随后的几年里,一系列针对传染病、超敏反应性疾病和癌症的mRNA疫苗陆续开始了临床前实验和临床试验。2009年,CureVac公司开展了首个mRNA癌症疫苗临床试验。2020年,mRNA新冠疫苗开展临床试验并在当年获得FDA紧急使用授权。
而如今,mRNA疫苗技术广泛应用于生物医学和纳米技术,从使用纳米颗粒的基因递送到使用各种纳米药物和纳米材料的基因治疗,开创了mRNA-纳米医学新时代。
mRNA-纳米医学新时代
在mRNA疫苗之前,人们已经开发的许多减毒疫苗或灭活病毒,通过触发身体的免疫系统来对抗传染疾病。但这些疫苗的开发既耗时又昂贵。相比之下,mRNA疫苗通过遗传指令引导人体细胞制造蛋白来激活免疫系统,具有“即插即用”的特点,开发时间更短、开发和生产成本更低。
既然如此,那么为什么直到2020年新冠大流行后,第一款mRNA疫苗才上市呢?
在mRNA研究的早期阶段,人们对这项新技术感到无比兴奋。然而,当时还面临着一些难以逾越的技术障碍有待解决。比如,mRNA会被身体吸收,并在其在细胞中被翻译为蛋白质之前迅速降解,这是当时面临的最难克服的挑战之一。此外,裸mRNA的递送同样充满挑战,因为mRNA难以高效穿越细胞膜。将mRNA封装在纳米颗粒中有助于保护和递送。脂质纳米颗粒(LNP)的出现,是安全、有效和稳定递送mRNA的重要突破。
2020年新冠大流行开始,此时,mRNA疫苗的所有组成成分都已到位——mRNA的化学修饰以及LNP的发明,让mRNA的保存和递送不再困难,此时,mRNA疫苗的成功开始进入倒计时。科学界开始重新集中精力,开发mRNA新冠疫苗。
Moderna和辉瑞/BioNTech率先开发出了两款基于mRNA-LNP的新冠疫苗,并在预防COVID-19方面的有效性超过90%。
由于mRNA分子的不稳定性,Moderna和辉瑞/BioNTech使用化学修饰来稳定mRNA(假尿苷修饰),并使用脂质纳米颗粒(LNP)来封装和递送这些mRNA。这些mRNA-LNP被注射到体内后,LNP会将表达新冠病毒刺突蛋白的mRNA递送到细胞内,并在细胞内表达刺突蛋白,从而让人体免疫系统做好识别新冠病毒的准备。
2020年,FDA批准了Moderna和辉瑞/BioNTech开发的两款mRNA新冠疫苗,这是人类历史上的首个获批生产的mRNA疫苗,而这两款mRNA从开发到获批和接种使用,还不到一年时间。
现在,下一步可能是实现口服或鼻腔吸入式的多模式纳米疫苗,将合成的mRNA定向递送到呼吸道,以增强疫苗的免疫刺激活性。口服或鼻腔吸入式疫苗可以减少患者的犹豫,增加依从性。鼻内吸入的方式还有一个好处,就是方便与其他疫苗联合接种,通过对疫苗进行简单的修改就能够适应病毒的新变种,联合粘膜和全身免疫反应,保护远端粘膜,更快地发生强大的免疫反应。此外,mRNA技术可以更方便地开发多价疫苗,从而同时抵御多种毒株,可以作为对抗未来可能出现的大流行的独特工具。
开发针对不同疾病的mRNA疫苗无疑将成为医疗健康领域的重点。目前正在开发几种mRNA疫苗,以预防和治疗多种疾病,包括针对EB病毒、巨细胞病毒、季节性流感、呼吸道合胞病毒、单纯疱疹病毒、乙型肝炎病毒、HIV病毒的预防性疫苗,以及针对癌症的治疗性疫苗。
尽管这些疫苗仍然面临一些挑战,例如监管问题、大规模生产、公众可及性,以及对于特定病原体可能难以诱导足够保护性免疫反应的问题,但它们也提供了一些优于传统疫苗的优点,包括安全性、有效性、快速制备和可适应性。
科学界和制药公司未来的主要目标应该是专注于开发新型递送系统和特异性递送系统,这些递送系统能够经受住多种生物障碍的考验,到达目标位点,从而提供长期的保护或治疗作用。
基于近年来在mRNA技术和递送载体技术上的进步,研究人员现在已经可以开发针对新兴传染病、罕见疾病,以及原本被忽视疾病的mRNA疫苗。
mRNA-纳米技术的未来
mRNA技术能够快速开发和生产,且不需要大规模的制造设施,世界各地的研究人员正在迅速开发基于mRNA技术的新型、突破性的疾病诊断和治疗应用。此外,mRNA疫苗是通过生化过程而非生物过程生产的,而传统疫苗技术依赖于细胞培养或其他手段(例如在鸡蛋中生产灭活病毒疫苗)。因此,mRNA疫苗的生产过程更简单、可靠。
由于生产流程简单,生产mRNA疫苗所需的时间也大大缩短,相比病毒载体疫苗和DNA疫苗的一个月的生产周期相比,mRNA疫苗只需3-7天。而且,整个生产过程无需细胞培养,因此,即使之前没有疫苗生产专业知识的药企也能快速且大量生产mRNA疫苗。
如今,已有数十亿美元资金投入到了mRNA疗法领域,越来越多的生物技术公司,包括Moderna、CureVac、BioNTech、Translate Bio、eTheRNA 和圣诺医药等等,它们在肿瘤、遗传疾病、心血管疾病和感染性疾病领域开发了一系列mRNA疗法或疫苗。
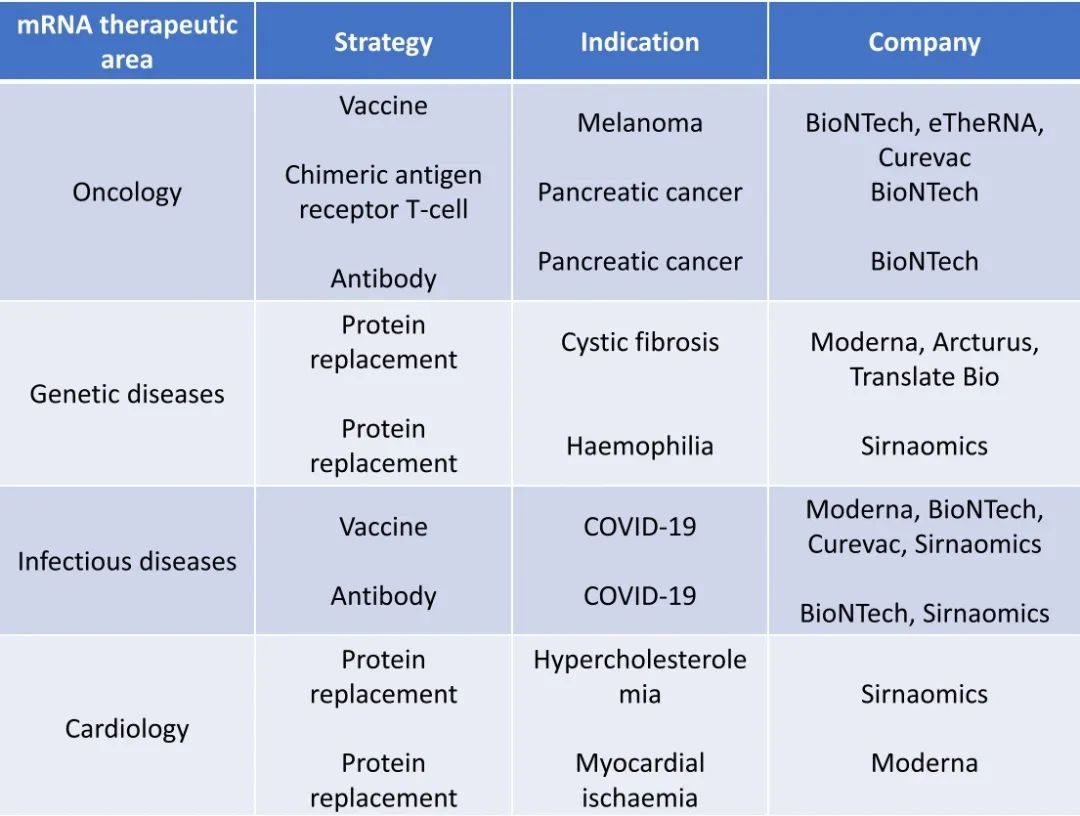
事实上,根据ClinicalTrials.gov网站的数据,除了COVID-19之外,还有200多项mRNA疫苗已经完成临床试验或正在积极招募参与者进行临床试验,其中针对癌症的mRNA疫苗临床试验就有近100项。
基于这些研究的结果,我们知道疫苗的风险-收益状况必须在免疫激活和炎症激活之间取得适当的平衡。此外,mRNA癌症疫苗作为单一疗法或与免疫检查点抑制剂联合使用的早期癌症临床试验结果显示出积极的结果。这表明这些mRNA疫苗即使对癌症或艾滋病等复杂疾病也有着很好的疗效。
临床角度来看,mRNA疫苗具有提供广谱免疫的潜力。由于mRNA疫苗仅受受体免疫系统对疾病的有效性的限制,如果发现有希望的候选蛋白质,定位相应的mRNA是一项简单的任务。随着快速生产管线的到位,mRNA疫苗技术可以在一种新病原体出现后的1-3个月内实现开发、生产和分发部署。
未来,下一代脂质纳米颗粒(LNP)将面临新的挑战,如提高其稳定性和多功能性,在设计时应考虑这一点,以增加其耐受性和安全性。未来的发展还包括单剂的第二代疫苗和针对多种突变株的多价疫苗,这些疫苗可能对新发病毒提供防御。
个性化疫苗是未来mRNA疫苗的另一种应用,它使用通用方法制造,可用于快速生产靶向患者特异性抗原的mRNA疫苗。除了直接免疫患者外,mRNA还可用于细胞治疗,在体外转染患者来源的细胞,以改变细胞表型或功能,然后将这些细胞扩增并回输到患者体内。
此外,人工智能和机器学习肯定有助于设计高度结构化的“superfolder”mRNA链,并使mRNA疫苗更安全、更易于保存和运输。通过更广泛地提供、负担得起、有效和安全的mRNA疫苗,以多管齐下的方法来减轻世界的重大疾病负担,这是极其重要的。
mRNA-纳米技术另一项潜在发展将是由稳定的纳米颗粒或局部支架贴片(例如微针)保护和递送的自扩增疫苗,这种疫苗可以在单次注射后在体内自我复制,从而减少注射剂量,甚至不需要加强注射。
mRNA疗法能够更好地将人类生理系统的生物学与新的mRNA有效载荷和体内纳米递送系统联系起来,提供具有可接受的安全性和更高精度、长度和持续时间的连续给药,这可能是其成功的关键。
这是mRNA疫苗技术和制造的新时代,它是遗传学和纳米医学交叉领域数十年研究进展的丰碑,这一交叉也将作为科学和医学研究中最伟大的成就之一载入史册。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


