Acta Pharm Sin B:基于TLR-2和ICB协同作用的三萜模板自组装纳米系统用于增强肝癌免疫治疗
来源:生物谷原创 2024-09-27 11:19
熊果酸通过TLR2-MyD88-TRAF6通路激活天然免疫系统,协同增强自然杀伤细胞和树突状细胞的增殖,与PD-L1的ICB结合,实现优秀的免疫细胞毒性T细胞浸润。
免疫治疗已成为临床癌症治疗的重要策略,特别是PD-1/PD-L1免疫检查点阻断(ICB)作为临床验证的治疗流形终末期癌症的方法。最近的研究表明,使用抗体或小分子药物进行全身给药的ICB治疗存在局限性,包括特异性低靶点、自身免疫反应的风险,以及由于个体差异大而存在的局限性。
随着CRISPR/Cas9基因编辑技术的出现,肿瘤ICB基因治疗的研究进展大大加快。基因治疗直接作用于免疫检查点基因,具有较高的基因编辑效率和治疗效,可有效降低癌细胞的增殖和扩散。然而,终末期肝细胞癌(HCC)患者的免疫应答率较低,也被证实处于免疫抑制肿瘤微环境(ITM)状态。与ICB单药治疗相比,联合治疗是治疗HCC的一种新的临床策略。
随着对天然产物有效成分研究的不断深入,药用植物中提取的黄酮类、多糖类和萜类化合物已被用作辅助治疗,具有有益的药理活性。熊果酸(UA)是一种从天然产物中提取的五环三萜化合物,具有抗癌、抗菌和抗转移等生物学功能。
作者之前的研究表明,UA不仅对肿瘤细胞增殖具有有效的抑制作用,而且具有独特的免疫激活作用。通过先天免疫和适应性免疫的多元免疫激活有效地克服了肿瘤ITM,表明潜在的联合治疗策略可以增强ICB治疗。考虑到病毒载体的潜在生物安全性,这种新型纳米技术已被证明是CRISPR/Cas9应用于癌症治疗的一种有效的传递系统。然而,纳米载体在体内的低载药量和未知的代谢仍然是临床应用的巨大障碍。
值得注意的是,研究者发现UA是一种通用自组装模板,可用于组合各种不同的疏水或亲水性分子以形成集成纳米药物。基于特异性的“药对药传递”体系,ua模板具有制备简单、载药量高、毒副作用低、降解速度慢等自组装纳米颗粒的更大优势。
此外,在成熟的仿生系统的帮助下,同源肿瘤细胞膜进一步增强了药物的靶向递送,降低了药物在体内的免疫吞噬作用。由于其高度聚合的结构,自组装纳米颗粒可以在表层包裹细胞膜,而不是在之前的研究中添加PLGA或其他框架分子来制备基于细胞膜的仿生系统。

图片来源:https://doi.org/10.1016/j.apsb.2024.04.033
近日,来自福州大学化学学院的研究者们在Acta Pharm Sin B杂志上发表了题为“Triterpenoids-templated self-assembly nanosystem for biomimetic delivery of CRISPR/Cas9 based on the synergy of TLR-2 and ICB to enhance HCC immunotherapy”的文章,该研究揭示了熊果酸模板策略通过建立自组装纳米系统,诱导肿瘤细胞死亡,促进肝癌治疗的协同免疫刺激,为肝癌治疗提供了一种有效的策略。
与免疫检查点阻断(ICB)单药治疗相比,联合免疫治疗在提高客观反应率方面显示出有希望的潜力。然而,多药联合治疗受到药物性质不同和靶向递送不一致的限制。本文以通用三萜模板和抗癌活性物质熊果酸(UA)为基础,设计了PD-L1靶向CRISPR/Cas9系统和UA自组装制备的膜包被仿生递送纳米平台(UR@M),用于肝细胞癌(HCC)的治疗。
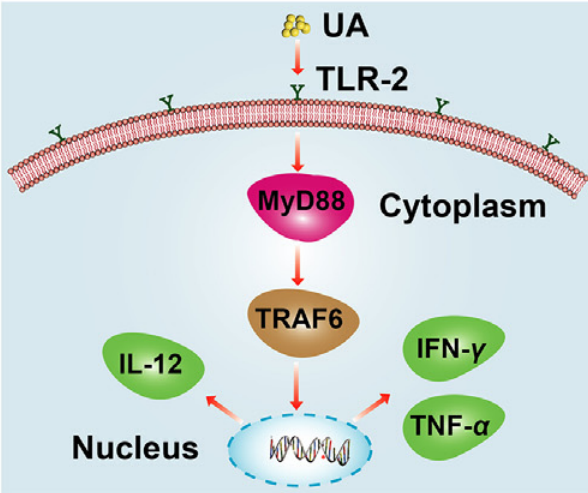
免疫细胞中TLR-2通路激活示意图
图片来源:https://doi.org/10.1016/j.apsb.2024.04.033
本研究成功构建了一种基于ua模板自组装的共递送纳米系统,用于结合CRISPR/Cas9的Cas9/RNP复合物和细胞跨膜肽。通用模板不仅用于小分子药物的自组装,也用于蛋白质的自组装。纳米药物UR@M具有良好的稳定性和sgRNA保护作用,并且通过细胞膜包衣的同源靶向进一步增强了高效的细胞摄取和肿瘤蓄积。UR@M有效抑制HCC细胞增殖和凋亡,诱导PD-L1的高基因编辑效率。
通过激活TLR-2-MyD88-TRAF6途径的先天免疫通路,敲除PD-L1基因,探索UR@M的协同免疫治疗。DC细胞的成熟促进了肿瘤免疫原性抗原的提呈,NK细胞和ctl诱导了有效的免疫治疗,对皮下和原位肿瘤模型均有良好的治疗效果。这种基于自组装纳米药物和CRISPR/Cas9系统的策略可能为HCC治疗提供潜在的选择。
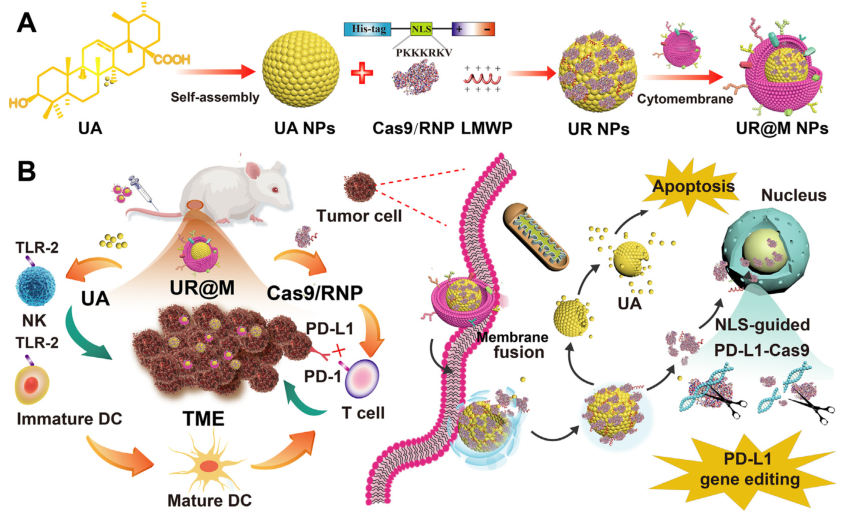
UR@M NPs用于HCC免疫治疗的治疗机制示意图
图片来源:https://doi.org/10.1016/j.apsb.2024.04.033
综上所述,熊果酸通过TLR2-MyD88-TRAF6通路激活天然免疫系统,协同增强自然杀伤细胞和树突状细胞的增殖,与PD-L1的ICB结合,实现优秀的免疫细胞毒性T细胞浸润。基于先天免疫和适应性免疫的双管齐下的工作策略在肿瘤消退中显示出显著的效果,这种基于自组装纳米药物和CRISPR/Cas9系统的策略可能为HCC治疗提供潜在的选择。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


