为什么人类失去了断肢再生的重生能力?最新SCI:部分哺乳动物在进化中被“关闭”Aldh1a2基因开关,无法激活再生程序
来源:生物谷 2025-07-30 13:56
也许有一天,我们真的能像电影中的超级英雄那样,在机体受伤后,重新长出失去的部分,焕然新生~
在奇幻的影视世界里,超级英雄们常常拥有令人惊叹的超能力,比如金刚狼那强大的自愈再生能力,无论受到多么严重的创伤,都能迅速恢复如初。而在现实生活中,很多更为低等的动物,例如壁虎、硬骨鱼、蝾螈等都能在断尾后重新长出尾巴,或是肢体缺损后完美再生。
相较于它们,咱哺乳动物的再生能力就显得极为有限了,这也可能是为什么“超强的再生能力”成为了电影中超级英雄的必备技能。以人类为例,心脏、中枢神经等重要器官一旦受损,往往因自我修复能力不足,致使器官功能严重受损甚至危及生命;即便借助先进医疗技术进行治疗,仍会留下终身伴随的疤痕。
于是,破解我们为什么失去了再生能力,以及如何重新获得强大的再生能力,成为了生物学及再生医学领域梦寐以求的目标。
这不,最近一项发表在《科学》杂志上的研究成果,为我们揭开了哺乳动物再生能力的神秘面纱,并带来了令人振奋的消息!研究团队发现,哺乳动物丧失再生能力的核心原因,竟是一个在进化中被“关闭”的基因开关——而重新打开它,能让小鼠实现“耳廓完美再生”!

本次研究选取了哺乳动物特有的外耳——耳廓作为研究对象,其原因在于不同哺乳动物的耳廓受损后,再生能力呈现出显著的差异,例如兔子和非洲刺毛鼠等,能够实现耳廓的再生,而小鼠和大鼠等则无法做到。这种独特的差异,为科学家们研究再生能力的分子机制提供了绝佳的线索。
由此,本研究就选取了能在一个月内修复4毫米-8毫米耳孔损伤的兔子和不具备这一“技能”的小鼠作为两组实验对象。
实验流程如下:首先,研究人员在不同哺乳动物的耳廓上制造全层穿孔损伤,模拟组织损伤模型。接着,通过单细胞 RNA 测序和空间转录组分析技术,对受伤耳廓组织进行分子层面的深入研究,对比不同物种在受伤后的基因表达差异,寻找与再生能力相关的关键基因和细胞类型。在这个过程中,研究人员收集了耳廓组织在不同损伤时间点(0 天、5 天、10 天等)的样本,以便观察基因表达随时间的动态变化。同时,他们还利用了腺相关病毒(AAV)介导的基因过表达技术,将潜在的关键基因导入小鼠耳廓的间充质细胞中,观察其对耳廓再生能力的影响。此外,为了验证外源性视黄酸(RA)的作用,研究人员对小鼠进行了 RA 的补充实验,通过腹腔注射的方式给予小鼠一定剂量的 RA,并观察耳廓损伤的修复情况。
是什么限制了我们的再生能力?
首先,研究发现,在损伤愈合的前期,有再生能力的兔子和不可再生的小鼠,其损伤部位形成的组织结构和细胞类型竟然高度相似,都存在着一群由损伤诱导产生的成纤维细胞(WIFs)。
什么是WIFs呢?WIFs 主要是负责合成和重塑细胞外基质,为伤口愈合提供结构支持,并通过分泌多种生长因子和细胞因子来调节炎症反应、促进血管生成以及招募其他类型的细胞参与修复过程。它们在细胞增殖、细胞外基质合成等方面发挥着关键作用,是损伤修复过程中的关键参与者。

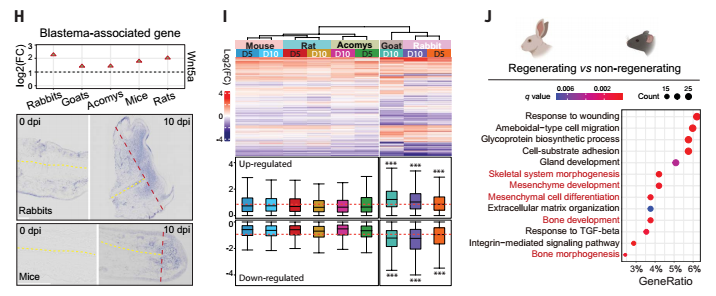
图1:展示了哺乳动物耳廓损伤后再生反应的进化差异性,通过系统发育分析、组织形态学、细胞增殖、分子表达等多个维度,对可再生与不可再生物种在耳廓损伤修复过程中的表现进行系统比较。该图揭示了哺乳动物再生能力的演化轨迹及其潜在的分子机制。
这一发现让人不禁好奇,既然前期如此相似,那究竟是什么导致了后续截然不同的结果呢?
通过单细胞和空间转录组联合分析,研究人员惊讶地发现,主导再生和组织修复差异的关键,不在于细胞数量或爆炸芽结构(blastema)的形成,而在于这群“伤口诱导型成纤维细胞”(WIFs)的基因响应质量。
在兔子这类具有再生能力的动物中,WIFs在损伤后会强烈激活一组组织形态发生相关的基因,如Bmp2、Lef1、Pdgfd、Scube2等,这些基因可以调控细胞的增殖、迁移及软骨等组织的重建。而在小鼠中,这些基因几乎“沉默”,取而代之的是一些促成纤维化、凋亡相关的通路。这就像是两组看似相同的演员,演出开始后却拿到了完全不同的剧本。
进一步研究发现,这一剧本之所以不同,关键在于一个“导演”——Aldh1a2基因。
Aldh1a2编码的蛋白是一种限速酶,参与合成视黄酸(RA),这是一种调控胚胎发育和组织再生的重要信号分子。在兔子等再生动物中,伤后Aldh1a2表达迅速上调,推动RA合成,从而激活整个再生程序;而在小鼠中,该基因的表达几乎检测不到,RA水平低下,导致WIFs无力执行“再生剧本”。
更令人震惊的是,这种表达差异并非由于基因本身缺失,而是由于其启动子和增强子(即基因的“开关”)在进化过程中逐渐沉默了。通过染色质互作(Micro-C)及ATAC-seq等技术,研究人员发现,兔子的Aldh1a2位点附近有多个活跃的增强子(如AE1和AE4),可以与启动子发生物理接触,启动转录。而小鼠和大鼠虽然保留了这些增强子的同源序列,但它们在损伤后却“不再点亮”Aldh1a2的表达。
这也许正是哺乳动物失去再生能力的根本原因:我们的“基因电灯泡”还在,但电源却开关坏了。
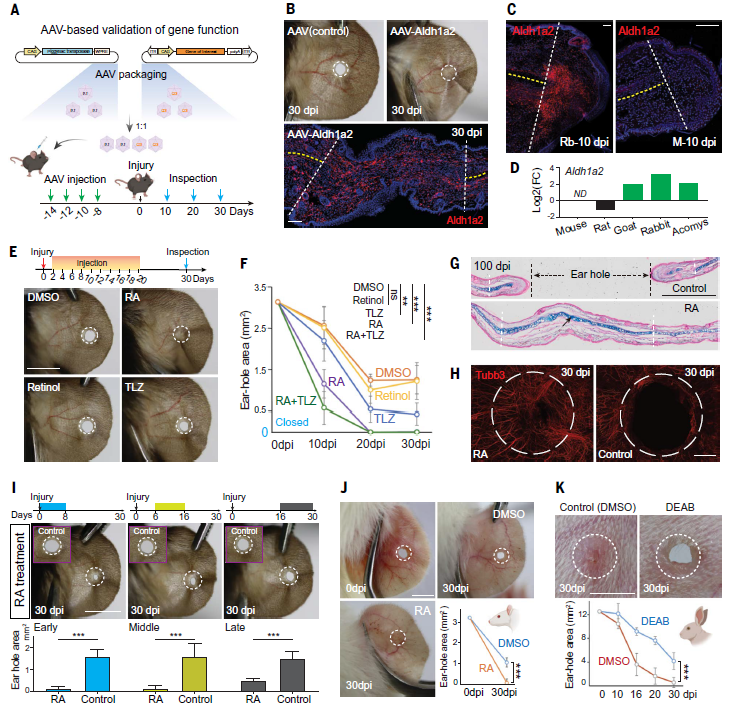
图2:展示了作者通过激活 Aldh1a2 表达或补充视黄酸(RA)信号,成功恢复小鼠耳廓再生能力的实验结果,明确指出Aldh1a2 缺失是小鼠耳廓再生失败的直接原因。该图分为多个子图,整体传递出一个清晰的信息链条:基因开关关闭 → RA合成不足 → 无法再生;打开开关或补充RA → 再生能力恢复。
我们是否能重启再生能力?
那么,如果我们重新打开这个“开关”,是否就能唤醒沉睡的再生能力?
答案是肯定的!
研究团队通过病毒介导的基因导入,在小鼠耳廓中强制表达Aldh1a2,结果惊人:这些小鼠不但成功再生了耳廓组织,甚至连软骨和神经都得到了恢复!
此外,研究者还通过腹腔注射外源视黄酸(RA)的方式,在未修改基因的普通小鼠体内激活再生程序。他们发现,单纯的RA补充(而非其前体retinol)同样可以促使耳孔完全闭合,形成类似兔子那样的完整再生结构。更有趣的是,联合使用RA和RA降解酶抑制剂(如TLZ)还能进一步加快再生速度,显示出RA在整个过程中的决定性作用。
不仅如此,研究还通过转基因手段将兔子来源的增强子AE1导入小鼠基因组,在未改变基因本体的情况下,仅仅是“更换了一个开关”,也足以显著增强Aldh1a2在小鼠耳廓中的表达,恢复一定程度的再生能力!
这不仅揭示了“基因开关”的重要性,也为未来再生医学提供了清晰的路径:或许我们不需要大规模更改基因组,只需精准修复或替代一些“沉默的调控器”,就能让失落的再生能力回归。
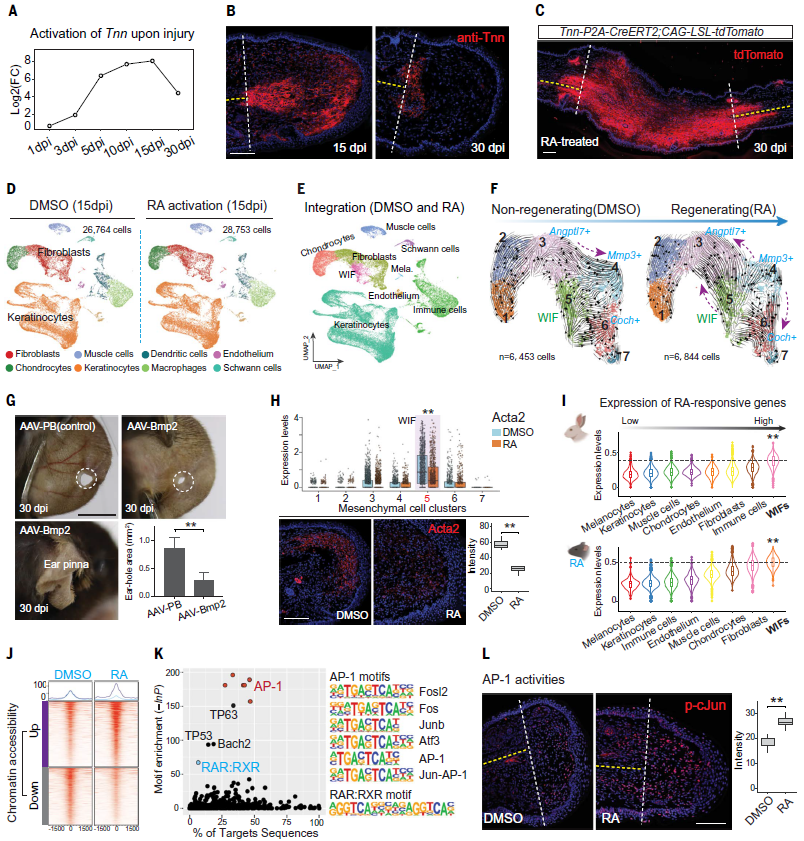
图3:本图展示了激活视黄酸(RA)信号后,小鼠耳廓中的伤后诱导型成纤维细胞(WIFs)如何被重编程,从而引导组织再生过程。同时,该图还揭示RA信号通过调控AP-1转录复合体,驱动关键基因表达,从分子到细胞层面解析了RA引发的再生机制。
从耳廓到心脏,我们能否再生整个身体?
这项研究的意义远不止于耳廓的重建!
视黄酸信号通路广泛参与多个器官系统的发育与再生,包括骨骼、皮肤、神经、肺乃至心脏。研究还发现RA与著名的再生调控因子AP-1复合体存在紧密协作:RA可增强AP-1的转录活性,从而激活再生相关基因。这一发现表明,RA通路可能是多种组织再生背后的共通机制。
如果我们能够进一步研究并激活RA信号在其他组织中的作用——比如心肌梗死后的心脏修复、脊髓损伤后的神经重建,甚至是肢体再生,那么未来“再生医学”的蓝图或许就不仅仅是梦想。
也许有一天,我们真的能像电影中的超级英雄那样,在机体受伤后,重新长出失去的部分,焕然新生~
参考文献:
Weifeng Lin et al., Reactivation of mammalian regeneration by turning on an evolutionarily disabled genetic switch. Science 388, eadp0176 (2025). DOI:10.1126/science.adp0176
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


