STTT | 海军军医大学谢渭芬/张新等合作揭示SOX9作为驱动YAP核转位的关键调节因子
来源:生物探索 2024-05-06 13:39
研究揭示了SOX9在YAP进入细胞核中的作用,并深入探讨了其潜在机制。
海军军医大学谢渭芬,张新及中国科学院上海药物研究所罗成共同通讯在Signal Transduction and Targeted Therapy在线发表题为”SRY-Box transcription factor 9 triggers YAP nuclear entry via direct interaction in tumors“的研究论文,该研究揭示了SOX9在激活YAP中的关键作用。SOX9通过直接相互作用促进了YAP的核转位。
重要的是,该研究发现SOX9的Asp-125与YAP的Arg-124之间的结合对于SOX9-YAP相互作用及随后的YAP核入至关重要。此外,该研究发现PRMT1催化的YAP在Arg-124上的新型不对称二甲基化(YAP-R124me2a)。YAP-R124me2a增强了YAP与SOX9的相互作用,并与多种癌症的不良预后相关。该研究使用竞争性肽S-A1破坏了SOX9与YAP之间的相互作用,该肽模拟了含有Asp-125的SOX9的α-螺旋结构。S-A1显著抑制了YAP的核转位并有效地抑制了肿瘤生长。这项研究首次提供了SOX9作为驱动YAP核转位的关键调节因子的证据,并提出了通过靶向SOX9-YAP相互作用治疗YAP驱动的人类癌症的潜在治疗策略。

Yes-associated protein(YAP)从细胞质向细胞核的转位是促进异常细胞生长和肿瘤发生的中心细胞事件。已经进行了大量研究以阐明调控YAP在细胞质中的封存和在细胞核中的保留的机制。在细胞质中,YAP与一组蛋白相互作用,包括14-3-3、AMOT、PTPN14和α-连环蛋白,它们负责将其封存在细胞质中。与之相反,YAP与其在细胞核中的伴侣直接结合,包括TEADs和MAML1/2,促进了YAP的细胞核保留,从而刺激了细胞增殖、存活和迁移,并推动了药物抵抗。
维持细胞质封存和细胞核保留之间的微妙平衡对于YAP的功能至关重要。此外,YAP含有一个常规的核出口信号,有助于其核出口。然而,与其果蝇同源基因Yorkie不同,尚未在哺乳动物YAP蛋白中鉴定出经典的核定位信号(NLS)。缺乏经典的NLS对于在哺乳动物细胞中调节YAP的核入的机制提出了一个有趣的问题。尽管施加到细胞核的力会通过减少核孔的机械限制而增加YAP的核入,但仍需要进一步的分子研究来解开YAP核入的机制及其在疾病发病机制中的潜在意义。
SRY相关高迁移率基因箱9(SOX9)作为转录因子,在各种生物学过程中发挥着关键作用,包括干细胞性、性别决定和祖细胞发育。SOX9已被广泛地表征为候选癌症干细胞标记物。SOX9在癌症发生、化疗抵抗和干细胞维持中的参与突显了其在肿瘤生物学中的关键调控功能。YAP和SOX9在许多肿瘤中被异常上调,它们作为驱动肿瘤进展的关键调节因子。YAP在几种肿瘤的发育过程中通过转录促进SOX9的表达,而SOX9在调节YAP活性方面的作用和机制尚存在争议。
已经证明,SOX9通过增加食管鳞状细胞癌中YAP靶向microRNA的水平来抑制YAP的表达。最近的研究表明,SOX9可能会破坏肝细胞中YAP/TEAD之间的协同相互作用,并改变YAP靶向基因的响应元件。相反,已经发现SOX9增加了YAP的活性,并在胃癌中促进了上皮间质转化(EMT)。这一发现表明,SOX9可能会作为YAP活性的正调节因子,这取决于细胞微环境和肿瘤的异质性。此外,虽然YAP的动态活性取决于其相对水平的核入,但SOX9是否影响YAP的核转位尚未得到探讨。
后转录修饰(PTM)是参与YAP核浆分布的重要调节机制。丝氨酸-127的磷酸化是通过Hippo途径介导的,这是决定YAP亚细胞定位的关键因素。这个过程作为14-3-3蛋白的结合位点,导致YAP在细胞质中的封存和抑制其靶基因的活性。影响YAP亚细胞定位的另一种PTM是由SET1A介导的赖氨酸342(K342)的单甲基化。YAP的这种修饰阻碍了CRMX1介导的YAP的核出口,导致其在多种肿瘤细胞的细胞核中的积累。PRMT1是I型蛋白精氨酸甲基转移酶(PRMTs)家族的主要成员。PRMT1选择性地催化底物蛋白的精氨酸残基上的不对称二甲基化(Rme2a,也称为ADMA)修饰。先前的研究已经揭示,PRMT1在肿瘤细胞中表达异常,并且甲基化多种涉及癌症侵袭性、药物敏感性和预后判断的底物蛋白。最近,已经验证了PRMT1通过精氨酸甲基化影响p14(ARF)的亚细胞定位和周转。值得注意的是,已经报道在软骨肉瘤标本中PRMT1水平升高与YAP的核积累呈正相关。然而,特定的YAP精氨酸甲基化是否负责其亚细胞定位尚未报道。
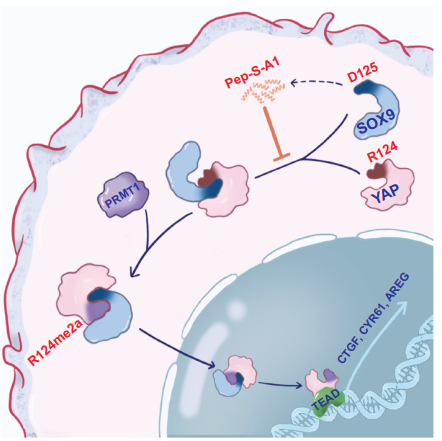
模式图(Credit: Signal Transduction and Targeted Therapy)
在本研究中,作者观察到当SOX9被敲除或沉默时,癌细胞中YAP的转录活性和核分数显著降低。作者确认了SOX9与YAP之间的直接相互作用,这一结果在体外和体内均有证实。此外,研究阐明了外源SOX9如何通过其在SOX9的Asp-125和YAP的Arg-124之间的特定相互作用促进YAP从细胞质进入细胞核的机制。作者还发现,PRMT1介导的YAP在R124处的不对称二甲基化增强了YAP与SOX9的结合,导致YAP在细胞核中的积累。高水平的YAP-R124me2a,而不是单独的YAP,预示着多种癌症的不良预后。基于这些发现,作者开发了一种选择性肽,模拟了含有D125(111-126a.a.)的SOX9片段,破坏了YAP与SOX9之间的相互作用,特异性地抑制了YAP驱动的HCC生长。研究揭示了SOX9在YAP进入细胞核中的作用,并深入探讨了其潜在机制。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


