《自然》:分析近10万个人体脑细胞,中国科学家终破解最常见儿童脑瘤起源之谜!
来源:奇点糕 2022-12-19 11:53
髓母细胞瘤(MB)是最常见的儿童恶性脑肿瘤。
髓母细胞瘤(MB)是最常见的儿童恶性脑肿瘤。
MB可分为4个亚群:WNT活化型、SHH活化型、Group3型和Group4型[1]。不同的MB亚群起源于发育中的小脑或脑干的不同细胞谱系,对治疗的反应差异也较大[2]。
其中,Group3型MB(G3-MB,约占MB的20%,原癌基因Myc活化)是最具侵袭性及预后最差的亚类[3],然而,其起源目前尚无定论。
以往科学家们对MB肿瘤起源的探索主要基于小鼠模型[2, 4],但人类小脑的表面积要比小鼠大750倍,有更多的原始祖细胞群体[5, 6],因而了解人类小脑发育过程中的细胞演变,对于寻找G3-MB的起源至关重要。
近日,由辛辛那提儿童医院医学中心的Richard Lu领导的中美研究团队,在《自然》杂志发表重磅研究[7],通过对人类胎儿大脑进行了单细胞分析,构建了小脑早期发育过程中的细胞图谱,并发现了一种独特的过渡性小脑祖细胞(以高表达HNRNPH1和SOX11为特征),而且它的转录特征与G3-MB高度相似。
他们还通过3D基因组结构分析证实,HNRNPH1/SOX11可促进过渡性小脑祖细胞发展为G3-MB肿瘤细胞。好消息是,他们证实靶向HNRNPH1/SOX11可抑制G3-MB肿瘤的生长。
这些研究的结果提示此前发现的过渡性小脑祖细胞很可能就是G3-MB的起源细胞,而且该类肿瘤的标志物HNRNPH1/SOX11可作为潜在的治疗靶点,G3-MB有望迎来新疗法。辛辛那提儿童医院医学中心的Luo Zaili和Zhao Chuntao,复旦大学附属儿科医院的Xia Mingyang和Shi Wei,以及上海交通大学医学院附属新华医院的Wang Jiajia是论文的共同第一作者。

论文首页截图
为了构建人类小脑发育过程中的细胞图谱,研究人员从孕后第8-17周的流产胎儿中分离出新鲜的小脑组织,并进行了单细胞RNA测序(scRNA-seq)。无监督聚类分析将所获得的95542个细胞分成了23个亚群,然后结合不同细胞系的典型标志物对其进行注释,识别出了人类胎儿小脑的主要细胞类型。
紧接着,研究人员通过干性评分描绘了神经细胞的群体演变轨迹,发现从神经干细胞到3个小脑的主要神经细胞系——颗粒细胞祖细胞(GCP)、单极刷状细胞(UBC)和Purkinje细胞之间存在过渡性小脑祖细胞(TCP)
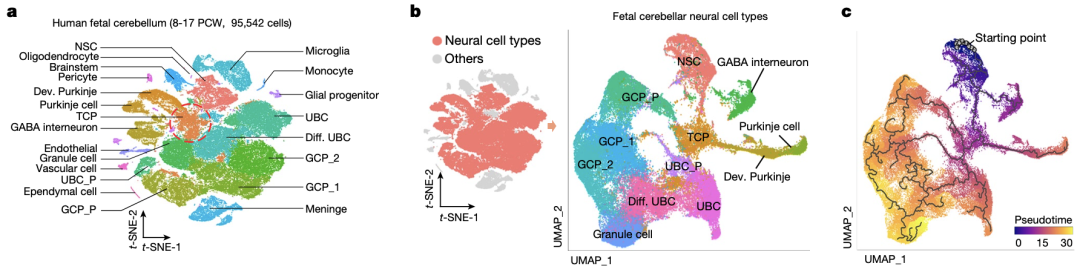
从神经干细胞到3个小脑的主要神经细胞系之间存在TCP
TCP在孕12周和13周时大量存在,在孕14周后期数目逐渐减少。TCP群体以高表达HNRNPH1和SOX11为特征,与先前定义的神经干细胞、GCP和UBC细胞群体特征不同,而与菱形唇(RL)中细胞基因特征存在一定相似性,这也与先前奇点报道的关于G3-MB起源的研究结果相一致[8, 9]。此外,TCP群体的分子特征在任何已知的小鼠小脑细胞群体中都没有富集。
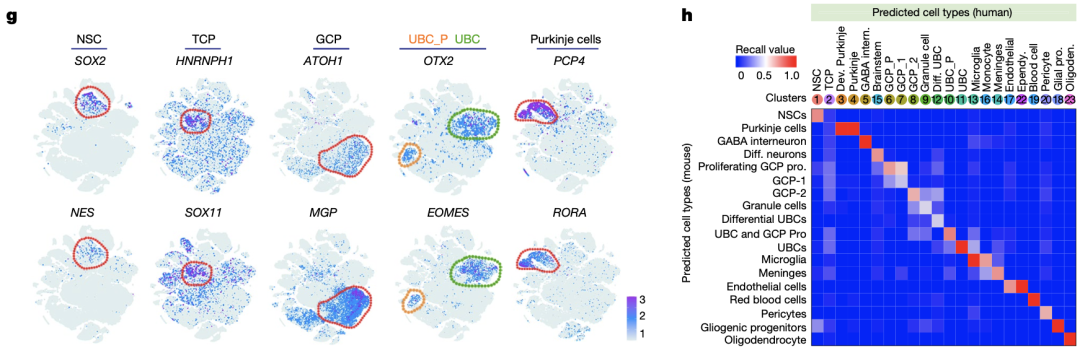
TCP的分子特征不同于神经干细胞、GCP和UBC等细胞群体
那新发现的细胞群体与MB存不存在关系呢?研究人员将儿童MB队列的转录组数据与TCP的转录特征进行比对,发现G3-MB与人类胎儿TCP群体相似性最强。
为了进一步确定TCP与小脑MB的联系,研究人员对26个MB组织进行了scRNA-seq和单核染色质转座酶可及性测序分析(snATAC-seq,研究染色质中DNA能与转录因子等蛋白复合物结合的区域)。
研究结果表明,在G3-MB、G4-MB和SHH活化型MB中均可发现类似TCP的细胞群体(同样高表达HNRNPH1和SOX11),而TCP样细胞群体在G3-MB中的丰度高于G4-MB和SHH活化型MB。这些结果表明,TCP细胞很有可能会演变为特定的肿瘤性TCP样细胞,也就是G3-MB的起源细胞。
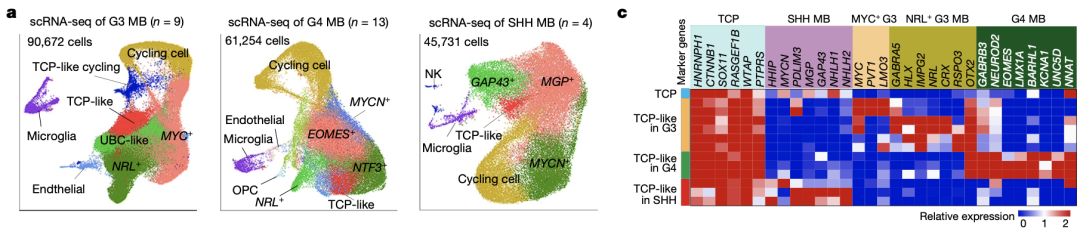
TCP细胞很有可能是G3-MB的起源细胞
此外,研究人员还发现,在一个原发肿瘤同时含有G3-MB和G4-MB组织类型的肿瘤病人中,其转移到脑膜处的肿瘤组织中TCP样细胞和MYC+G3-MB细胞的频率都有所增加,但G4-MB细胞有所减少,表明TCP样细胞与G3-MB细胞具有一致的高侵袭性。
为了探究顺式调控元件(CRE)的动态可及性与侵袭性MB的TCP样细胞基因调控的关系,研究人员对G3-MB进行了snATAC-seq,并进行伪时间序列分析,发现TCP样细胞群出现优先于MYC+细胞群,在TCP样细胞中,SOX11和TWIST1的结合域明显富集,而在MYC+细胞群中则是TCF3和MYC结合域明显富集。
同时,G3-MB肿瘤细胞的GO分析,在TCP样细胞群体中,上皮发育、上皮-间质转化(EMT)和TGFb/BMP信号显著富集,这与其具有的高侵袭性相一致。
以上结果均再次表明了TCP样细胞就是G3-MB细胞的“老祖宗”。那么TCP样细胞是如何转变为G3-MB肿瘤细胞的呢?
研究人员基于患者来源的MYC活化的G3-MB肿瘤细胞系(MB-004和MB-002),发现TCP样细胞中高表达的SOX11/HNRNPH1可驱动原癌基因Myc活化,导致G3-MB的发生。
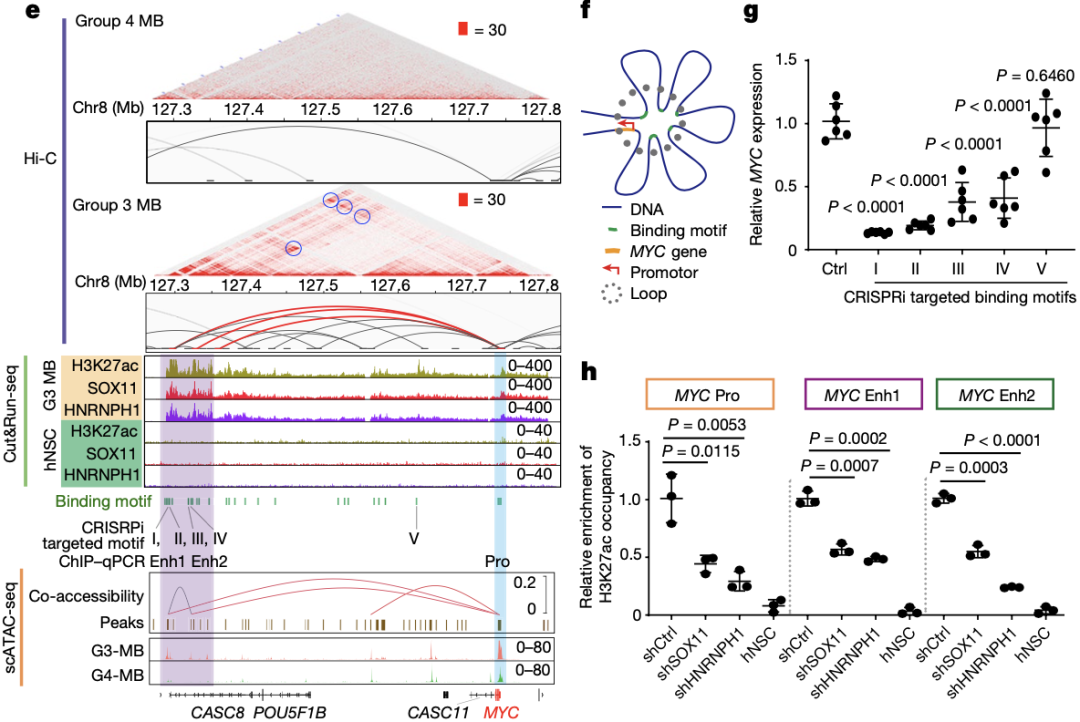
TCP样细胞中高表达的SOX11/ HNRNPH1可驱动原癌基因MYC活化
最后,研究人员发现,通过短发夹RNA(shRNA)沉默肿瘤细胞中的HNRNPH1或SOX11后,观察到Myc表达的大幅降低,并抑制了肿瘤细胞的生长。
此外,体内实验也表明,在HNRNPH1或SOX11被沉默后,G3-MB肿瘤生长速度也被明显抑制,小鼠的生存期明显延长,表明TCP标志性基因HNRNPH1和SOX11的表达,对侵袭性G3-MB肿瘤的生长至关重要。
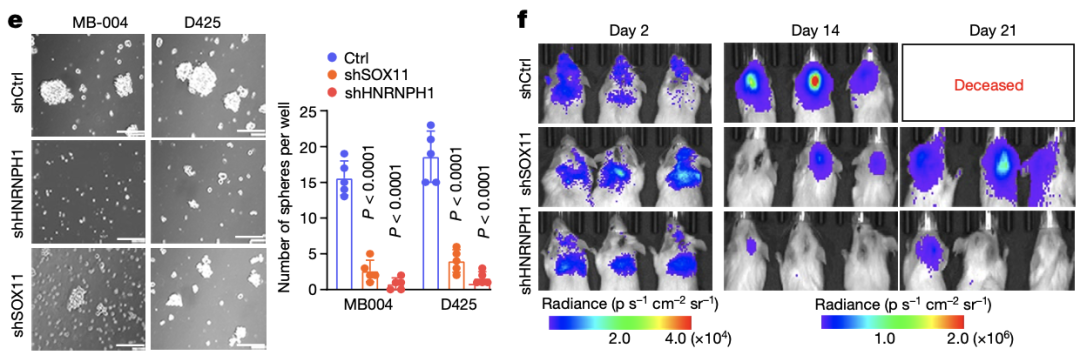
体内及体外实验表明TCP标志性基因HNRNPH1和SOX11的表达对G3-MB肿瘤的生长至关重要
总的来说,本研究通过建立人胎儿小脑细胞发育图谱,找到了一类新的介于神经干细胞和成熟神经元之间的过度细胞,该细胞群体以表达HNRNPH1和SOX11为特征,且证实了HNRNPH1和SOX11可驱动原癌基因Myc的活化,从而导致G3-MB肿瘤的发生发展。
更重要的是,HNRNPH1和SOX11还可作为干预靶点来抑制肿瘤的生长,若能找到可特异性干预这两个靶点的小分子化合物,或将成为G3-MB治疗的新方向。
参考文献
1.Wang J, Garancher A, Ramaswamy V, Wechsler-Reya RJ: Medulloblastoma: From Molecular Subgroups to Molecular Targeted Therapies. Annu Rev Neurosci 2018, 41:207-232.
2.Vladoiu MC, El-Hamamy I, Donovan LK, Farooq H, Holgado BL, Sundaravadanam Y, Ramaswamy V, Hendrikse LD, Kumar S, Mack SC et al: Childhood cerebellar tumours mirror conserved fetal transcriptional programs. Nature 2019, 572(7767):67-73.
3.Pugh TJ, Weeraratne SD, Archer TC, Pomeranz Krummel DA, Auclair D, Bochicchio J, Carneiro MO, Carter SL, Cibulskis K, Erlich RL et al: Medulloblastoma exome sequencing uncovers subtype-specific somatic mutations. Nature 2012, 488(7409):106-110.
4.Hovestadt V, Smith KS, Bihannic L, Filbin MG, Shaw ML, Baumgartner A, DeWitt JC, Groves A, Mayr L, Weisman HR et al: Resolving medulloblastoma cellular architecture by single-cell genomics. Nature 2019, 572(7767):74-79.
5.Aldinger KA, Thomson Z, Phelps IG, Haldipur P, Deng M, Timms AE, Hirano M, Santpere G, Roco C, Rosenberg AB et al: Spatial and cell type transcriptional landscape of human cerebellar development. Nat Neurosci 2021, 24(8):1163-1175.
6.Haldipur P, Aldinger KA, Bernardo S, Deng M, Timms AE, Overman LM, Winter C, Lisgo SN, Razavi F, Silvestri E et al: Spatiotemporal expansion of primary progenitor zones in the developing human cerebellum. Science 2019, 366(6464):454-460.
7.Luo Z, Xia M, Shi W, Zhao C, Wang J, Xin D, Dong X, Xiong Y, Zhang F, Berry K et al: Human fetal cerebellar cell atlas informs medulloblastoma origin and oncogenesis. Nature 2022.
8.Smith KS, Bihannic L, Gudenas BL, Haldipur P, Tao R, Gao Q, Li Y, Aldinger KA, Iskusnykh IY, Chizhikov VV et al: Unified rhombic lip origins of group 3 and group 4 medulloblastoma. Nature 2022, 609(7929):1012-1020.
9.Hendrikse LD, Haldipur P, Saulnier O, Millman J, Sjoboen AH, Erickson AW, Ong W, Gordon V, Coudiere-Morrison L, Mercier AL et al: Failure of human rhombic lip differentiation underlies medulloblastoma formation. Nature 2022, 609(7929):1021-1028.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


