Cell Stem Cell: 科学家们揭示了有效地减轻了宿主免疫细胞的排斥反应的机制
来源:生物谷原创 2024-07-30 09:57
本研究结果强调,自然发生的逃逸策略可以作为增强细胞治疗的蓝图,并支持遗传消融粘附配体(如CD54和CD58)能够操纵免疫突触以避免供体免疫细胞排斥的概念。
同种异体细胞免疫疗法由于多重基因编辑的可能性、强大的可扩展性和现成治疗的按需可用性,有可能克服自体细胞疗法的某些局限性。然而,同种异体供体细胞的免疫原性和输注细胞产物被宿主排斥带来了相当大的挑战,这阻碍了广泛的临床应用。
遗传缺失β -2微球蛋白(B2M)基因通过消除人类白细胞抗原(HLA) i类的细胞表面表达,成功地消除了CD8+ T细胞反应性的一个主要分支。相应地,缺失HLA II类反激活子(CIITA)导致HLA II类缺失,从而排除CD4+ T细胞反应,结合这两种方法可以大大避免T细胞介导的排斥反应。然而,HLA I类的缺失可能会触发宿主自然杀伤(NK)细胞的自我识别缺失,因此需要额外的免疫调节策略来限制宿主NK细胞介导的排斥反应。
免疫突触的形成是NK细胞和T细胞激活过程中的一个早期事件,也是杀死靶细胞所必需的。靶细胞上的粘附配体CD54 (ICAM-1)和CD58 (LFA-3)分别与效应细胞上的粘附受体LFA-1和CD2结合,促进稳定突触的形成。
靶细胞侧CD54和CD58的缺失有助于病毒感染细胞和肿瘤逃避免疫监视。因此,研究者假设,通过基因删除配体来限制宿主细胞对供体细胞的粘附,对自然发生的病毒和肿瘤免疫逃逸机制进行逆向工程,可能会减轻同种异体细胞产物的排斥反应。

图片来源:https://doi.org/10.1016/j.stem.2024.06.011
近日,来自瑞典斯德哥尔摩卡罗林斯卡医学院哈丁医学系感染医学中心的研究者们在Cell Stem Cell杂志上发表了题为“Genetic ablation of adhesion ligands mitigates rejection of allogeneic cellular immunotherapies“的文章,该研究揭示了粘附配体的基因消融可减轻同种异体细胞免疫疗法的排斥反应。
同种异体细胞免疫疗法具有广泛的临床应用前景,但由于宿主免疫系统对供体细胞的潜在排斥而面临局限性。沉默β -2微球蛋白(B2M)的表达通常被用来逃避宿主T细胞介导的排斥反应,尽管B2M的缺失可能会引发宿主自然杀伤细胞(NK)的自我缺失反应。
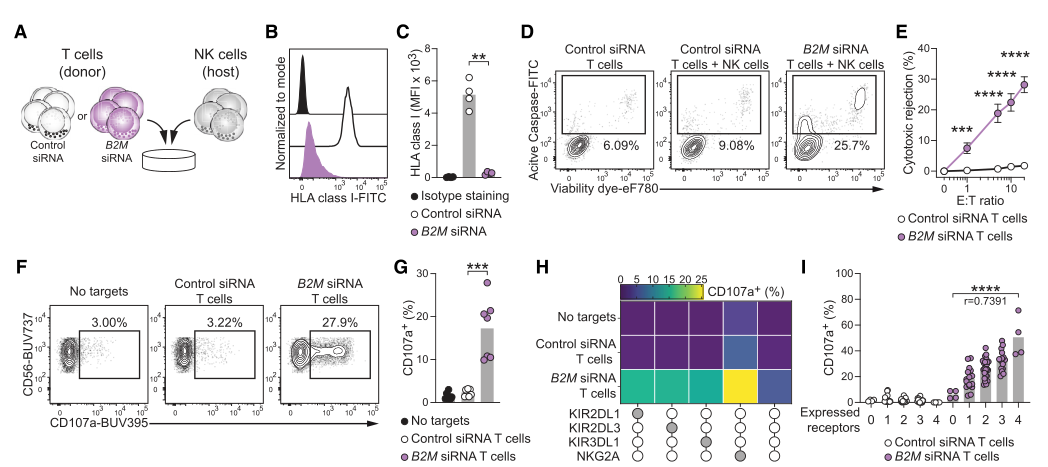
CD54和CD58基因消融普遍抑制NK细胞活性
图片来源:https://doi.org/10.1016/j.stem.2024.06.011
在本研究中,研究者证明了bm2缺陷嵌合抗原受体(CAR-T)细胞和多编辑诱导多能干细胞(iPSC)衍生的CAR - NK细胞中粘附配体CD54和CD58的遗传缺失降低了它们在体外和体内对宿主NK细胞排斥的敏感性。
黏附配体的缺失限制了b2m缺乏和b2m充足情况下的单向排斥反应,而不影响工程供体细胞的抗肿瘤功能。因此,这些数据表明,粘附配体的基因消融有效地减轻了宿主免疫细胞的排斥反应,促进了通用免疫治疗的实施。
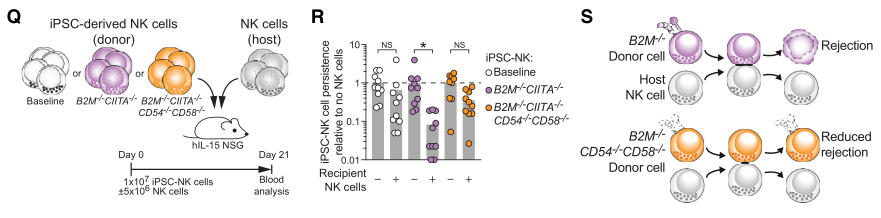
多编辑B2M- / - ciita- / - cd54- / - cd58- / - ipsc衍生的CAR NK细胞在体外和体内均保持其功能并表现出对NK细胞排斥的抗性
图片来源:https://doi.org/10.1016/j.stem.2024.06.011
总的来说,调节免疫突触是优化免疫细胞过继转移的功能特性和持久性的一种有前途的策略。本研究结果强调,自然发生的逃逸策略可以作为增强细胞治疗的蓝图,并支持遗传消融粘附配体(如CD54和CD58)能够操纵免疫突触以避免供体免疫细胞排斥的概念。(生物谷 Bioon.com)
参考文献:
Quirin Hammer et al. Genetic ablation of adhesion ligands mitigates rejection of allogeneic cellular immunotherapies. Cell Stem Cell. 2024 Jul 2:S1934-5909(24)00219-4. doi: 10.1016/j.stem.2024.06.011.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


