《胃肠病学》:MD安德森癌症中心陈阳团队发现增效胰腺癌免疫治疗的关键靶点!
来源:奇点糕 2024-03-15 11:39
MD安德森癌症中心的研究者们首先分析了PDAC模型小鼠(KPC小鼠),经单细胞RNA测序证实,PDAC细胞及肿瘤微环境中的髓系细胞均存在编码GAL3的Lglas3基因高表达。
近日,美国MD安德森癌症中心陈阳课题组在《胃肠病学》(Gastroenterology)期刊发表最新研究成果,揭示了可介导胰腺导管腺癌(PDAC)免疫抑制、促进癌症进展的又一关键靶点——半乳糖凝集素-3(Galectin-3/GAL3),将GAL3连同其代偿机制,即敲除GAL3后表达上调的趋化因子CXCL12一同抑制,可有效增强PD-1抑制剂对PDAC的疗效[1]。
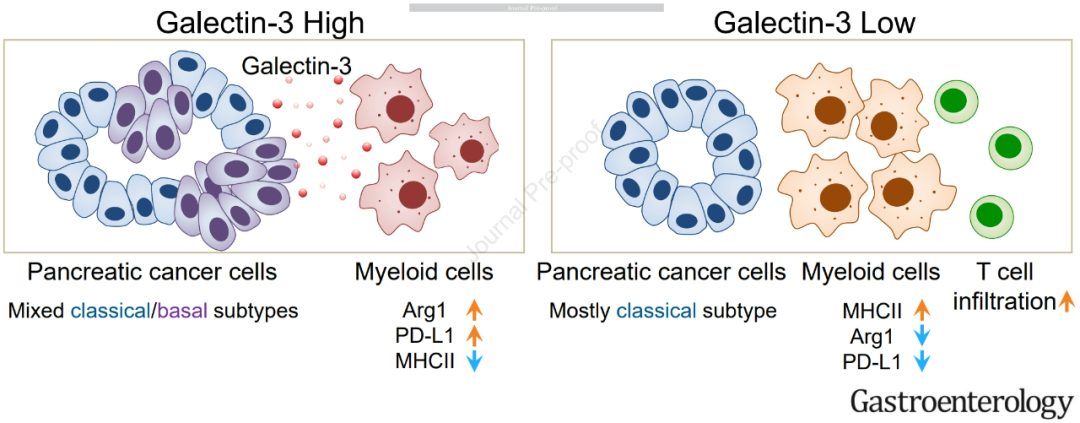
论文核心内容总结
此前已有许多基础研究显示,GAL3所属的半乳糖凝集素家族对T细胞、B细胞乃至抗原呈递细胞(APCs)等众多关键免疫细胞亚群都有显著影响[2],例如GAL3就参与了T细胞激活和分化的调控,且早就有学者在PDAC中发现了GAL3的过表达[3],所以选择它为研究对象并不奇怪,但难就难在一并找到癌细胞“见招拆招”,被敲除GAL3后的代偿机制。
MD安德森癌症中心的研究者们首先分析了PDAC模型小鼠(KPC小鼠),经单细胞RNA测序证实,PDAC细胞及肿瘤微环境中的髓系细胞均存在编码GAL3的Lglas3基因高表达;而在人PDAC肿瘤样本中,高表达GAL3的比例也接近一半(45%,其余55%为中表达),且高表达GAL3与患者预后不良,即总生存期(OS)和无进展生存期(PFS)较短相关。
而在自发性胰腺癌小鼠模型(KPPC小鼠)中,敲除Lglas3基因可使小鼠生存期显著延长,发生PDAC也明显比对照组小鼠更晚;单细胞测序显示,敲除Lglas3即GAL3的小鼠PDAC微环境中髓系细胞富集更显著,且存在一类高表达MHC-II类分子基因(如H2-Aa、H2-Ab1)的髓系细胞亚群(亚群1),它们与助力抑癌的M1型肿瘤相关巨噬细胞(TAMs)较为相似。
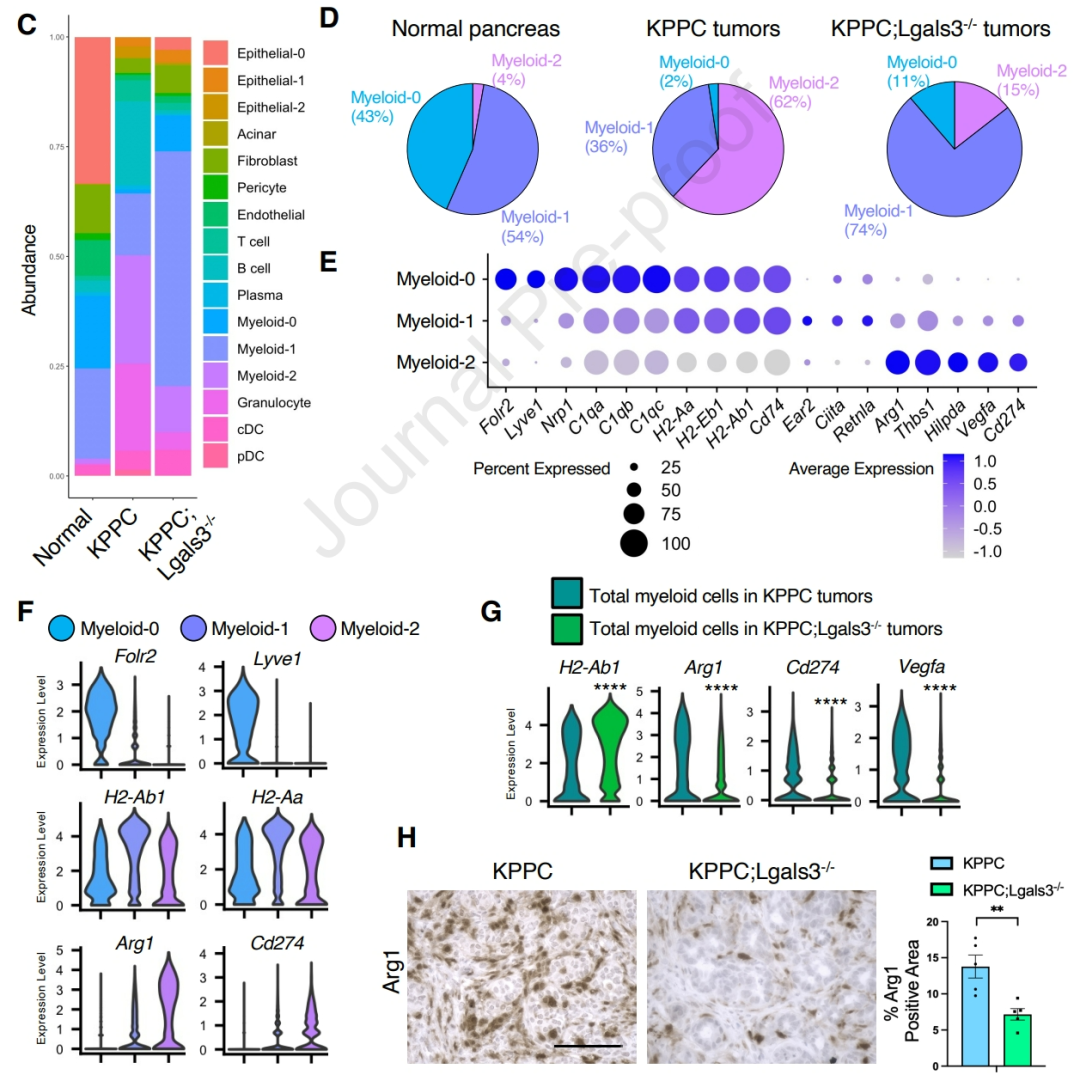
敲除小鼠GAL3后,PDAC微环境中可检出一类较特殊的髓系细胞
髓系细胞亚群1高表达MHC-II类分子,就意味着它们呈递抗原的能力可能较强,能更好地激活抗肿瘤免疫应答;而表征和功能类似M2型TAMs的髓系细胞亚群2,以及类似组织驻留巨噬细胞的亚群0,则在敲除GAL3后的PDAC微环境中减少了,这还会使肿瘤整体的PD-L1表达水平下降。不过,敲除GAL3对其它免疫细胞影响并不大,仅有FoxP3+CD4+调节性T细胞数量显著增多。
此外,PDAC的细胞外基质也是免疫治疗必须突破的障壁,异质性显著的肿瘤相关成纤维细胞(CAFs)又是构建细胞外基质的主力,而敲除GAL3也波及到了CAFs,使炎症型CAFs(iCAFs)显著富集,且它们还存在趋化因子CXCL12的表达显著上调;敲除PDAC细胞的GAL3,也会直接使CXCL12表达上调。
敲除PDAC细胞的GAL3表达还有其它影响,首先是表征为基底/间质样型(basal/mesenchymal-like)的PDAC细胞占比明显下降,它们以高表达Tff2、Cdh1和Vsig2等基因为特征;其次,敲除GAL3还使NF-κB信号通路基因表达显著下调,进而使Cyclin D1蛋白减少,这会让PDAC细胞成瘤能力减弱,且对KRAS G12D抑制剂治疗更敏感。
最后,基于此前发现敲除GAL3与CXCL12表达显著上调有关,研究者们推测同时抑制GAL3和CXCL12-CXCR4(CXCL12的受体)通路,才有可能提供增效免疫治疗的机会窗口,并在小鼠实验中证实,对敲除GAL3的小鼠使用CXCR4抑制剂,可通过增加CD4+效应T细胞和CD8+细胞毒性T细胞数量,与PD-1抑制剂实现协同增效,更有力地抑制PDAC。
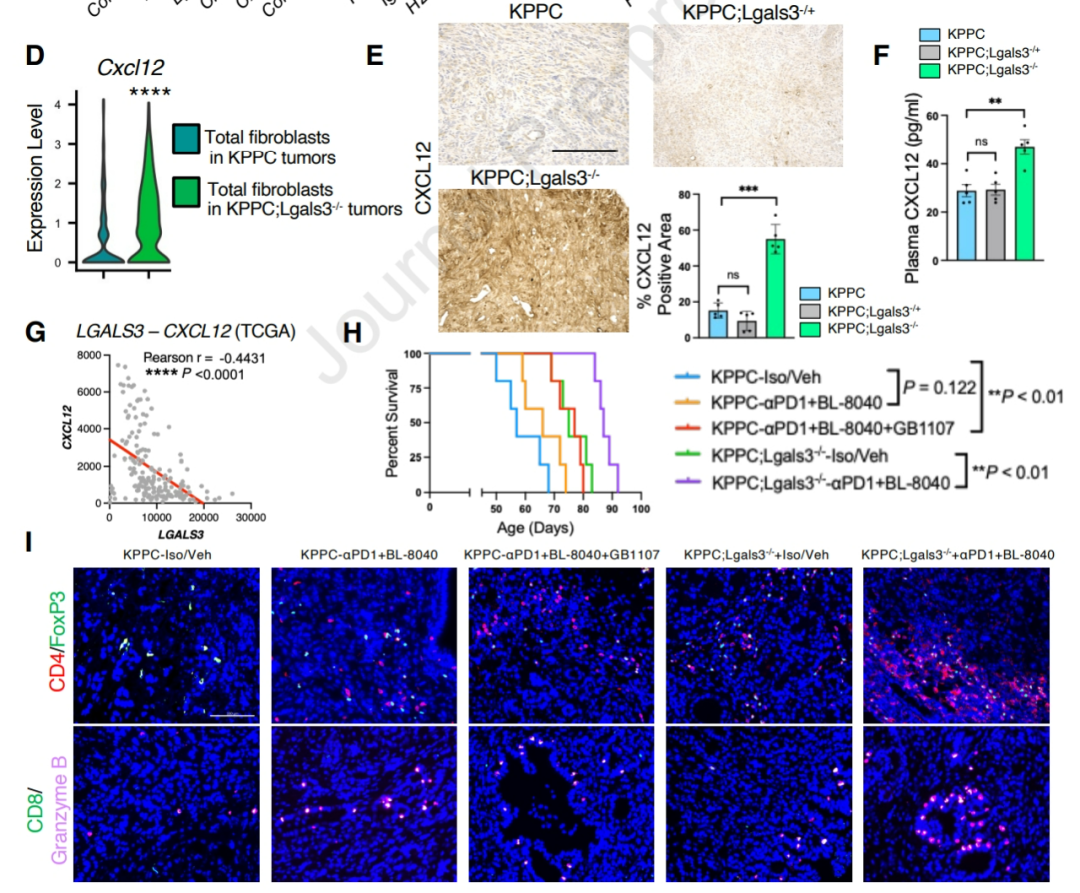
敲除GAL3+CXCR4抑制剂+PD-1抑制剂的三联方案才够强力
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


