NRCO权威综述:肺癌围术期免疫治疗正高歌猛进,当前的挑战和未来的机遇这篇文章说清楚了!
来源:奇点糕 2023-08-10 18:01
从上面的一系列问题可以看出,可手术NSCLC围术期免疫治疗的“大厦”还远未建成,天空飘着各种各样颜色的云,解决这些问题不仅需要更多的临床研究和数据,还需要先进的检测手段、常态化多学科会诊和药物可及性等
最近三年,绝对是可手术非小细胞肺癌(NSCLC)围术期免疫治疗的“收获季节”,关键临床研究成果相继揭晓:2021年免疫辅助治疗的IMpower010研究率先“撞线”,2022年免疫新辅助治疗的CheckMate-816研究双主要终点“双喜临门”,2023年又有两项采用“夹心饼”免疫治疗模式的III期研究宣告成功。
接连不断的捷报,当然会让人对NSCLC围术期免疫治疗充满期待,但或许发展越是火热,就越需要一点“冷思考”:比如截至目前,临床研究还无法明确哪一种治疗模式才是改善患者生存、提升临床治愈率的最优解,类似的问题还有单药与联合治疗之争、不同疗效终点向总生存期(OS)获益的转化程度等等。
新生事物发展就是这样,及时看清前路才是关键。近期,欧美多国专家就在《自然评论·临床肿瘤学》上共同撰文[1],盘点了截至2023年中NSCLC围术期免疫治疗取得的进展,以及未来的机遇与挑战。太长不看?绝对后悔!

论文首页截图
NSCLC围术期不同免疫治疗模式的作用机制
1)免疫辅助治疗
可手术NSCLC在术后的复发和转移风险较高,这主要与患者体内仍残存有肉眼不可见的微转移灶有关,且由于手术创伤、应激等原因,患者术后往往会处于短暂的免疫抑制状态[2];因此在术后尽快使用免疫辅助治疗,有望逆转免疫抑制来擒住微转移灶,还有望与临床实践中长期使用的辅助化疗实现协同增效。
2)免疫新辅助治疗
相较免疫辅助治疗,学界认为免疫新辅助治疗在理论上有多重优势[2],即使不谈缩瘤降期等外科获益,在尚未切除原发肿瘤前,患者体内肿瘤新抗原数量也较多,使用免疫治疗就能更好地调动更广泛的抗肿瘤免疫应答,并有效扩增肿瘤特异性记忆T细胞,且新辅助治疗还可较早通过病理检查预估疗效。
3)“夹心饼”式免疫治疗
当前取得临床研究成功的“夹心饼”模式,均为术前免疫+化疗新辅助治疗,再配合术后为期约1年的免疫辅助治疗,从而集新辅助和辅助治疗的获益于一身,目前仍在进行中的关键临床III期研究也多为“夹心饼”式。
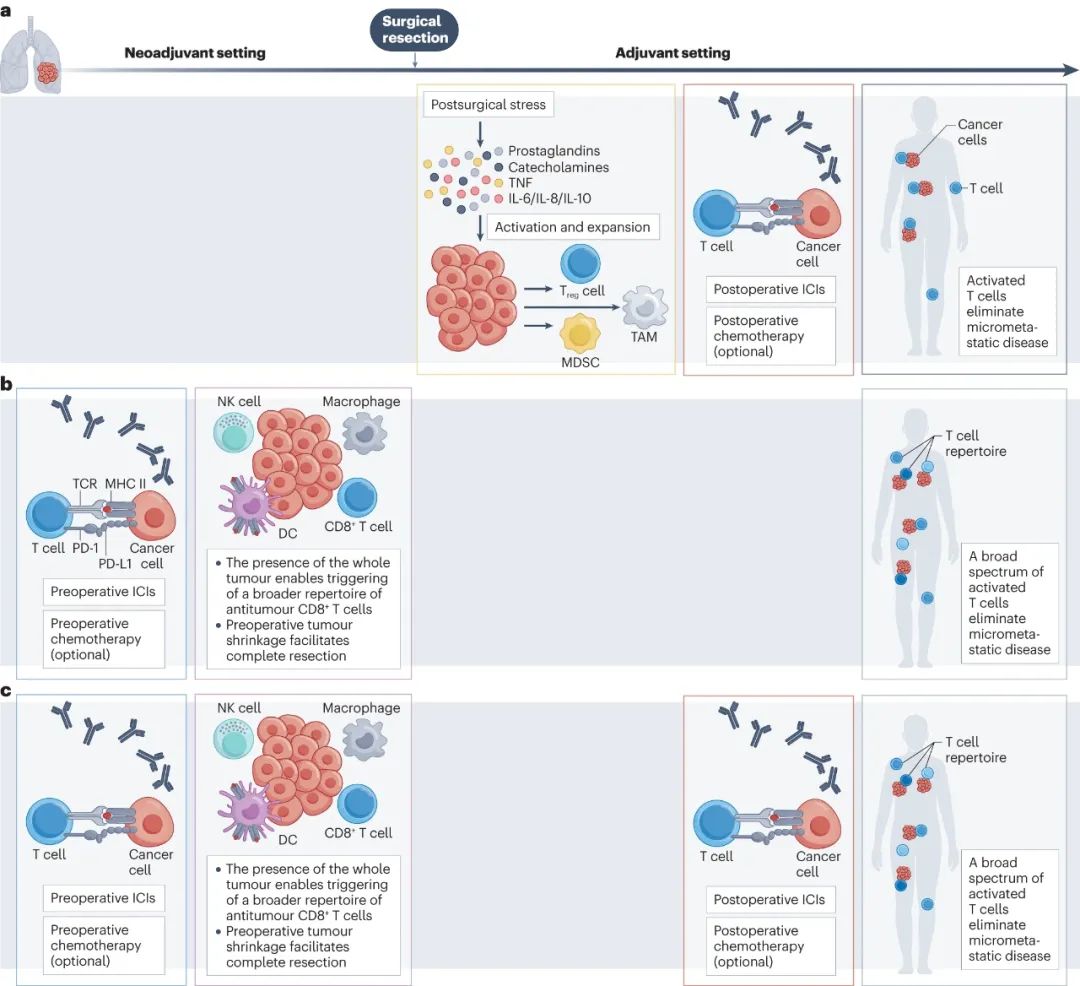
不同免疫治疗模式的作用机制示意图
免疫新辅助治疗现状
2018年登上《新英格兰医学杂志》的Checkmate-159(CA209-159)研究,首次证实免疫新辅助治疗可有效缩瘤降期,并使45%患者达到主要病理学缓解(MPR),10%达到病理学完全缓解(pCR),且初步疗效也转化为高达80%的5年生存率。
自此之后,免疫新辅助治疗就开始一路狂奔,成果亮眼的临床I/II期研究层出不穷,不过治疗方案逐步从Checkmate-159研究的免疫单药治疗,转变为MPR/pCR率更高的免疫联合治疗,其中免疫+化疗联合方案的探索进度最快。
如作为最先报告阳性结果的新辅助治疗临床III期研究,CheckMate-816研究即使用术前3个周期的纳武利尤单抗+含铂双药化疗(术后患者可接受辅助化疗/放疗/放化疗,但不同于免疫“夹心饼”模式),在pCR率(24.0%/2.2%)和中位无事件生存期(EFS,31.6个月 vs. 20.8个月)双主要终点上均达到阳性结果。
除免疫+化疗方案外,NEOSTAR、NEOpredict-Lung(纳武利尤单抗+LAG-3抑制剂Relatlimab)等研究还初步探索了双免疫方案的可行性;2023年美国临床肿瘤学会(ASCO)年会上,免疫+抗血管联合新辅助治疗方案也正式亮相(EAST ENERGY研究),其MPR/pCR率分别为50%和33%,但副作用问题较为突出[4]。
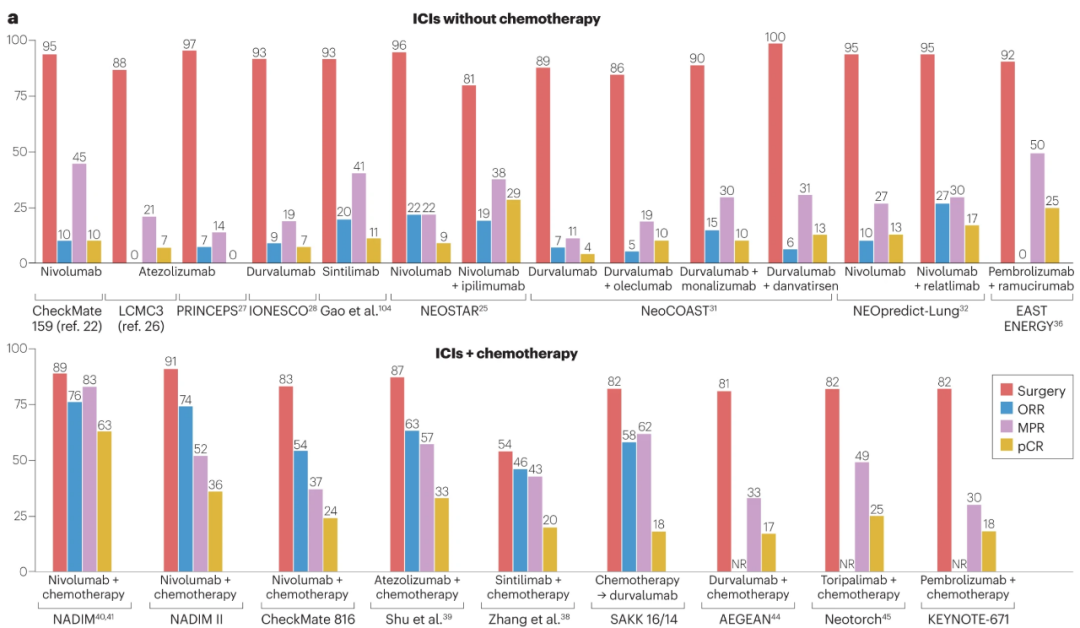
新辅助阶段免疫单药/联合治疗的疗效数据对比
免疫辅助治疗现状
免疫辅助治疗已有IMpower010、KEYNOTE-091/PEARLS两项关键临床III期研究达到无病生存期(DFS)主要终点,但两项研究的设计和疗效数据有所区别:IMpower010研究纳入患者需完成术后辅助化疗,阿替利珠单抗辅助治疗1年的方案可显著延长II-IIIA期患者中位DFS,以及PD-L1阳性II-IIIA期患者中位OS。
KEYNOTE-091/PEARLS研究的主角则是帕博利珠单抗,且不强制要求患者入组前接受辅助化疗(但实际有>85%患者接受化疗);免疫辅助治疗在全人群中达到DFS阳性结果,但却未能显著延长PD-L1高表达(TPS≥50%)患者的中位DFS,这一点与IMpower010研究截然相反,也引起了学界的广泛关注和激烈讨论。
上述两项研究的亚组分析还显示,IIIA期患者可能是从免疫单药辅助治疗中获益最显著的人群,但无法更进一步阐明指导用药的患者特征或生物标志物,可能有待正在进行的BR.31、ANVIL等研究给出答案,但稍显遗憾的是,在设计上应用分子残留病灶(MRD)的免疫辅助治疗研究(MERMAID系列研究)据称已提前“被砍”。
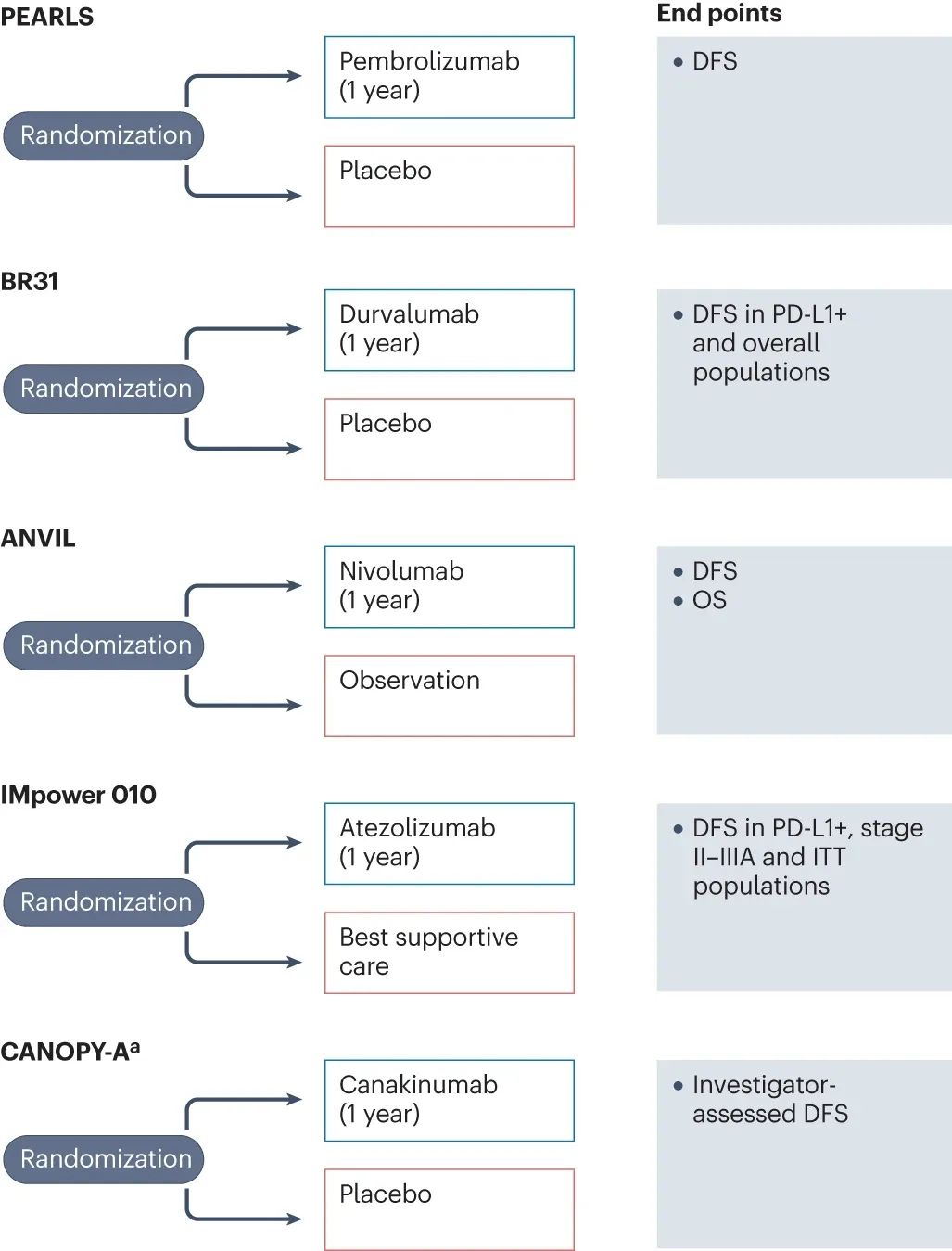
正在进行中的免疫辅助治疗关键临床研究
“夹心饼”式免疫治疗现状
主要探索免疫新辅助治疗可行性的NADIM、LCMC3等标志性临床早期研究,其实都同时给“夹心饼”式免疫治疗的可行性提供了证据,特别是患者长期生存率相当出色,如NADIM研究中IIIA期患者的3年OS率高达81.9%[5],后续开展的随机对照研究NADIM II,也于近期正式发表了出色的生存获益数据。
而在2023年,AEGEAN、NEOTORCH、KEYNOTE-671三项设计相似的随机对照临床III期研究,相继公布MPR/pCR和EFS阳性结果,标志着“夹心饼”式免疫治疗全面成功,奇点糕此处就不列举疗效数据了。不过截至本文发稿时,“夹心饼”式免疫治疗尚未正式获批应用,可能与上述研究OS数据均未成熟有关。
其它正在进行的“夹心饼”式免疫治疗关键临床III期研究中,新辅助阶段采用免疫+立体定向放疗(SBRT)方案的KEYNOTE-867研究也值得关注,此前在临床II期研究中,免疫+SBRT方案治疗的MPR/pCR率为53.3%/26.7%[6]。
说了这么多大家耳熟能详的成果,NSCLC围术期的免疫治疗,前景似乎是一片光明,可是哪有100%顺利的事情呢?接下来就该进入机遇与挑战的篇章啦。
NSCLC围术期免疫治疗的机遇与挑战
外科手术考量
不论是哪种围术期免疫治疗模式,都不能“喧宾夺主”、取代外科手术切除,这也是免疫新辅助和辅助治疗的差异所在:前者虽然可以缩瘤降期、更好地激活免疫应答,但也确实存在治疗期间因病情进展或显著副作用,导致患者失去手术机会的风险,而免疫辅助治疗则不会对外科手术进程产生影响。
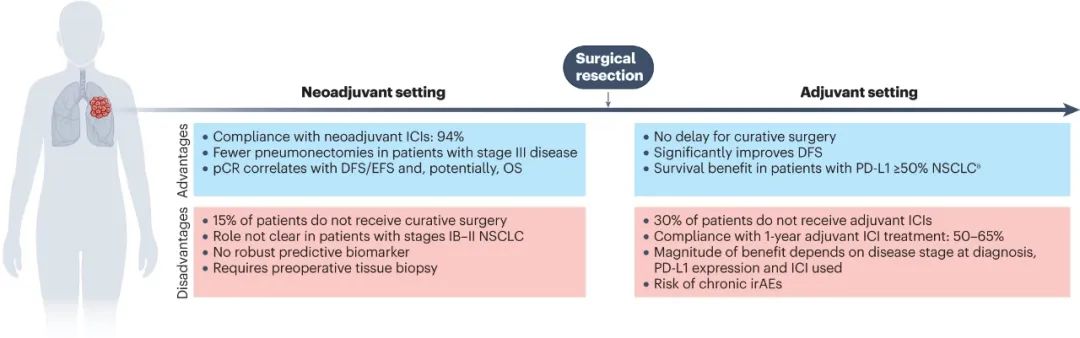
从外科视角看免疫新辅助和辅助治疗的差异
在关键临床III期研究中,接受免疫新辅助治疗或“夹心饼”式免疫治疗的患者,至多有20%无法按计划完成外科手术切除,甚至有II期研究报告称,接受免疫新辅助治疗患者的术后90天内死亡率高达9%[7],这可能与免疫治疗激活的免疫和炎症反应过强有关,外科医生必须全盘考虑、权衡每一例患者的利弊。
此外,现有的免疫新辅助治疗研究均未考虑“转化治疗”,即将初始判定不可切除的NSCLC转化为可切除的用法,研究入组患者均为初治可切除患者(大多为IB-IIIA期,少数含IIIB期患者),对减少手术中肺切除范围的影响也不明显,这些问题有待后续研究给出答案。
临床实践适用性问题
就治疗依从性而言,免疫新辅助治疗一般只需2-4个21天周期,因此大多数患者能够接受,但为期1年的免疫辅助治疗就不同了,IMpower010和KEYNOTE-091研究的辅助治疗完成比例分别只有65%和52%,未来临床医生可能需要基于新辅助治疗或生物标志物情况,筛选最有可能获益或最需要免疫辅助治疗的患者。
另一大问题则是免疫新辅助/辅助治疗,与当前临床常规诊疗流程的“兼容性”,例如免疫辅助治疗前患者是否必须经受辅助化疗、具体应采用何种含铂化疗方案;免疫新辅助治疗前是否需检测EGFR/ALK等驱动基因突变等,现有临床研究的相关亚组分析普遍样本量偏小且非预设,回答这些问题仍比较困难。
液体活检和生物标志物的应用
多项免疫新辅助治疗临床研究都开展过ctDNA检测相关分析,普遍显示新辅助治疗后患者ctDNA水平下降乃至完全清除,与更高的MPR/pCR率及患者更好的长期预后有关,特别是CheckMate-816研究中,ctDNA完全清除患者有46%达pCR,因此将基于ctDNA的液体活检与影像学等手段联合使用,有较好的临床价值。
免疫辅助治疗中目前流行的评估标准,则是近年来备受关注的分子残留病灶(MRD),检测指标也主要是ctDNA,但IMpower010研究的探索性分析显示,患者术后MRD是否阳性,对阿替利珠单抗的治疗获益影响不大,MRD仅应作为预后评价指标而非免疫疗效预测指标[8],未来可能需要更精准动态的评估手段。
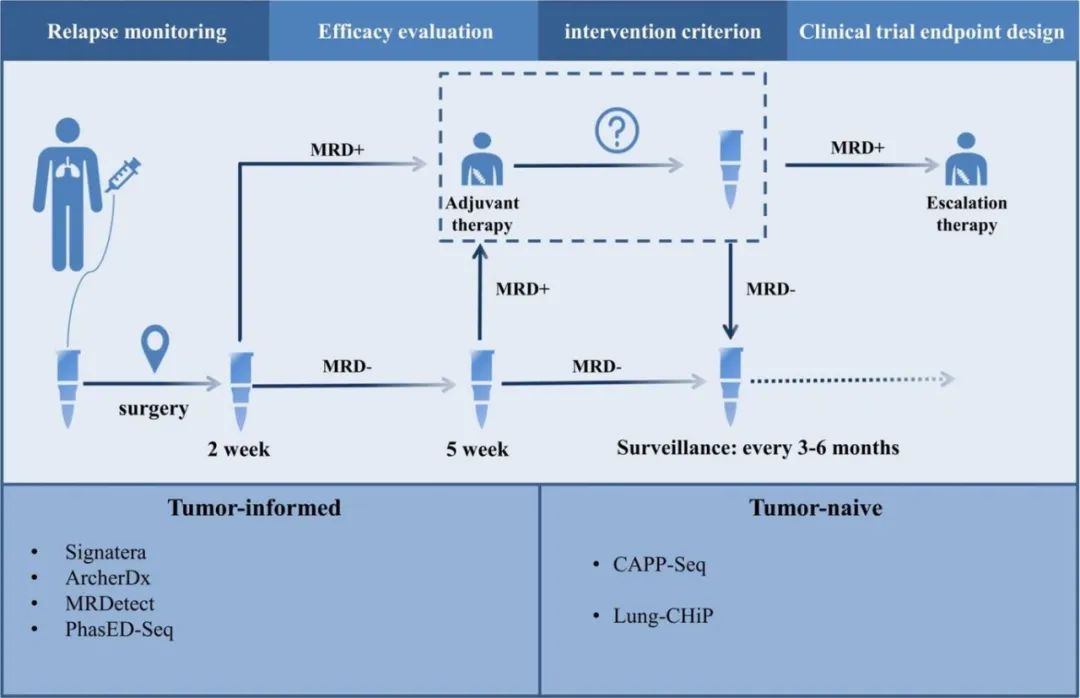
MRD对免疫辅助治疗的指导意义
(图片来源:Critical Reviews in Oncology/Hematology)
驱动基因阳性患者的治疗
针对EGFR、ALK等常见驱动基因突变,以及罕见驱动基因变异的TKI类靶向药已非常成熟,靶向辅助治疗已有标志性的ADAURA研究结果公布,新辅助治疗临床研究也接近收获期,但对存在TP53、STK11等常见共突变,且尚无靶向药可用的患者,是否应行围术期免疫治疗仍是“知识盲区”,亟需相关分析。
辅助治疗用药时长问题
IMpower010和KEYNOTE-091研究均将免疫辅助治疗时长定为1年(即17个周期),但并无法验证1年时长是否为最优解。从免疫治疗用于晚期NSCLC的经验来看,达到缓解的患者持续用药可长期获益,而在免疫辅助治疗阶段,可能需要以新辅助治疗的病理应答情况即是否达到MPR/pCR,或患者基线特征来判断用药时长。
临床研究终点选择问题
OS无疑是抗癌治疗临床研究的金标准,但在可手术NSCLC的临床研究中,得到OS结果往往需要较长时间的随访,且结果还会受到许多因素的干扰,如晚期NSCLC靶向和免疫治疗临床研究中,后线治疗就有极大的影响。
围术期免疫治疗关键临床研究中,OS基本都作为次要终点,MPR/pCR和DFS、EFS等“替代终点”普遍是研究主要终点,但仍无权威证据提示“替代终点”对OS的预示意义。此外,免疫治疗还可能通过预防继发/第二次恶性肿瘤发生,改善临床研究OS数据,具体影响幅度则需要更多数据和更长久的随访。
疾病复发后的免疫治疗“再挑战”
晚期NSCLC免疫治疗临床研究数据显示,对疾病复发/进展患者尝试免疫再挑战有一定获益[9],在可手术NSCLC患者中的可行性则尚无证据,如现有临床研究的随访较为完善,应尽快评估免疫再挑战对患者预后的影响,以及最优的治疗模式、用药时长等,这也是临床医生和患者高度关注的问题。
结语
从上面的一系列问题可以看出,可手术NSCLC围术期免疫治疗的“大厦”还远未建成,天空飘着各种各样颜色的云,解决这些问题不仅需要更多的临床研究和数据,还需要先进的检测手段、常态化多学科会诊和药物可及性等方面的改进,众人拾柴火焰高、多方面努力肺癌治愈希望才高嘛。
参考文献:
[1]Mountzios G, Remon J, Hendriks L E L, et al. Immune-checkpoint inhibition for resectable non-small-cell lung cancer—opportunities and challenges[J]. Nature Reviews Clinical Oncology, 2023.
[2]Matzner P, Sandbank E, Neeman E, et al. Harnessing cancer immunotherapy during the unexploited immediate perioperative period[J]. Nature Reviews Clinical Oncology, 2020, 17(5): 313-326.
[3]Liu J, Blake S J, Yong M C R, et al. Improved efficacy of neoadjuvant compared to adjuvant immunotherapy to eradicate metastatic disease[J]. Cancer Discovery, 2016, 6(12): 1382-1399.
[4]Aokage K, Shimada Y, Yoh K, et al. Pembrolizumab and ramucirumab neoadjuvant therapy for PD-L1-positive stage IB-IIIA lung cancer (EAST ENERGY)[J]. Journal of Clinical Oncology, 2023, 41(Supplement_16): 8509.
[5]Provencio M, Serna-Blasco R, Nadal E, et al. Overall survival and biomarker analysis of neoadjuvant nivolumab plus chemotherapy in operable stage IIIA non–small-cell lung cancer (NADIM phase II trial)[J]. Journal of Clinical Oncology, 2022, 40(25): 2924-2933.
[6]Altorki N K, McGraw T E, Borczuk A C, et al. Neoadjuvant durvalumab with or without stereotactic body radiotherapy in patients with early-stage non-small-cell lung cancer: a single-centre, randomised phase 2 trial[J]. The Lancet Oncology, 2021, 22(6): 824-835.
[7]Wislez M, Mazieres J, Lavole A, et al. Neoadjuvant durvalumab for resectable non-small-cell lung cancer (NSCLC): results from a multicenter study (IFCT-1601 IONESCO)[J]. Journal for Immunotherapy of Cancer, 2022, 10(10): e005636.
[8]Zhou C, Thakur M D, Srivastava M K, et al. 2O IMpower010: Biomarkers of disease-free survival (DFS) in a phase III study of atezolizumab (atezo) vs best supportive care (BSC) after adjuvant chemotherapy in stage IB-IIIA NSCLC[J]. Annals of Oncology, 2021, 32(Supplement 7): S1374.
[9]Rodriguez-Abreu D, Wu Y L, Boyer M, et al. OA15. 06 Pooled Analysis of Outcomes with Second-Course Pembrolizumab Across 5 Phase 3 Studies of Non-Small-Cell Lung Cancer[J]. Journal of Thoracic Oncology, 2022, 17(9 Supplement): S42-S43.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


