科学家们近期在胰腺癌研究领域取得的新进展!
来源:生物谷原创 2023-01-30 14:29
本文中,小编整理了多篇重要研究成果,共同解读科学家们近期在胰腺癌研究领域取得的新进展!分享给大家!
本文中,小编整理了多篇重要研究成果,共同解读科学家们近期在胰腺癌研究领域取得的新进展!分享给大家!
【1】Cancer Sci:科学家识别出抵御人类胰腺癌的关键分子靶点
doi:10.1111/cas.15615
如今,胰腺癌依然是全球人群面临的最致命性的恶性肿瘤之一,由于胰腺导管腺癌(PDAC)患者的5年生存率仅为3%左右,因此在全球范围内PDAC都很难利用外科手术进行治疗,为了开发出新型疗法策略,研究人员就需要在分子水平上更好地理解PDAC的生物学特征。近日,一篇发表在国际杂志Cancer Science上题为“Identification of a novel target of SETD1A histone methyltransferase and the clinical significance in pancreatic cancer”的研究报告中,来自东京医牙大学等机构的科学家们通过研究识别出了一种新型靶向性基因,其或许对于PDAC病例有着很强的临床意义。
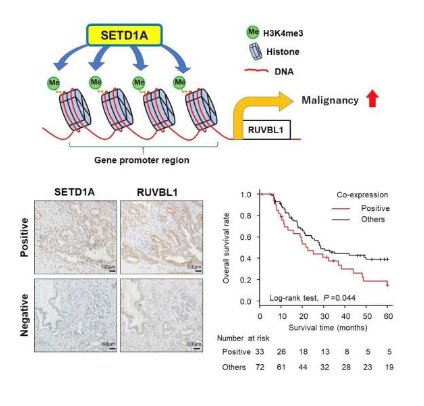
科学家识别出抵御人类胰腺癌的关键分子靶点。
图片来源:Cancer Science (2022). DOI:10.1111/cas.15615
此前研究结果表明,癌细胞能表达一种由SETD1A基因所编码的高水平的特殊酶类—组蛋白H3K4甲基转移酶(histone H3K4 methyltransferase),该酶能通过甲基化化学基团添加到特定靶向性基因的组蛋白(染色质必要的结构组分)上,这一过程就称之为甲基化过程,然而,诱发该酶类过表达以及其对癌细胞效应的分子机制,目前研究人员并不清楚。
当组蛋白发生甲基化后,靶向性基因就会被激活,如果SETD1A的靶向性基因能支持癌症的发育和进展,这一点就特别具有意义,因此,研究人员非常感兴趣理解SETD1A的过表达在PDAC中所扮演的关键角色。研究者Takeshi Ishii说道,尽管此前研究结果表明,SETD1A在多种癌症中处于过表达装填,比如胃癌和肺癌等,但我们并不清楚其在PDAC中的特定分子事件,PDAC中SETD1A的靶向性基因目前尚未被确定或识别。
【2】Nat Cancer:三种免疫检查点抑制剂联合使用有望治疗胰腺癌
doi:10.1038/s43018-022-00500-z
近日,一篇发表在国际杂志Nature Cancer上题为“Targeting T cell checkpoints 41BB and LAG3 and myeloid cell CXCR1/CXCR2 results in antitumor immunity and durable response in pancreatic cancer”的研究报告中,来自美国德克萨斯大学MD安德森癌症中心的研究人员通过研究发现了一种新型的三种免疫疗法的联合使用,靶向T细胞和髓样抑制细胞中的免疫检查点,成功地重编程了肿瘤免疫微环境,并大大改善了胰腺癌临床前模型中的抗肿瘤反应。
在这项新的研究中,这些作者在小鼠和人类胰腺癌中使用了全面的免疫分析,以系统地确定免疫疗法抵抗性机制并研究潜在的治疗靶标。他们发现,中和肿瘤免疫微环境的几种不同的免疫抑制机制极大地提高了实验室模型的生存率,指出了这种极其致命的无反应性的癌症的潜在治疗方案。研究者Ronald DePinho博士表示,这种三联免疫疗法在我们的模型中导致了前所未有的治愈性反应。普遍的观点是胰腺癌对免疫疗法无能为力,但这项临床前研究表明,胰腺癌在正确的联合疗法面前也会很脆弱。此外,这些靶标在人类胰腺癌样本中的存在,提出了令人兴奋的可能性,即这种治疗组合有一天可以帮助我们的患者。
胰腺癌是美国癌症死亡的主要原因之一,部分原因是80%的病例是在晚期诊断出来的。胰腺癌也被认为是“非免疫原性的”,意味着它对常用的抗PD-1和抗CTLA-4免疫检查点抑制剂没有反应。这部分是由于肿瘤免疫微环境中的免疫抑制条件造成的,但这种抵抗背后的机制还没有完全被理解。这些作者使用高维免疫分析和单细胞RNA测序来研究肿瘤免疫微环境如何受到多种免疫疗法的影响。他们确定了特定的免疫检查点蛋白---41BB和LAG,它们在功能衰竭的T细胞中高度表达。
【3】Science:科学家有望利用自我增压的特殊T细胞来杀灭胰腺癌细胞
doi:10.1126/science.aba1624
许多实体瘤都对T细胞疗法没有反应,因为其免疫抑制微环境阻断了T细胞的浸润、激活和增殖;近日,一篇发表在国际杂志Science上题为“Synthetic cytokine circuits that drive T cells into immune-excluded tumors”的研究报告中,来自加州大学旧金山分校等机构的科学家们通过研究对T细胞进行工程化改造产生了一种强大的抗癌细胞因子,但只有其遇到肿瘤细胞时才会产生,这种免疫疗法能消除小鼠机体中的黑色素瘤和胰腺癌,且并不会产生明显的副作用,其或许为抵御上述以及其它难以治疗的癌症提供了一种潜在的新型策略。
这些细胞能产生IL-2,这种强大的炎性分子能通过机体免疫系统自然产生,其能增强T细胞的功能,而T细胞则是一种能杀灭癌细胞并保护机体抵御感染的特殊免疫细胞,尽管几十年来肿瘤学家一直知道IL-2具有潜在的抗癌活性,但由于其在全身给药时所产生的毒性反应,往往让其使用一直会受到限制。这篇研究报告中,研究人员通过对肿瘤浸润的T细胞进行编程来使其在识别癌细胞时会产生自身的IL-2,从而就会使得细胞因子一直被控制在癌症内。研究者Wendell Lim博士说道,我们已经利用了这些细胞作为局部运输制剂的能力,并且金当其识别到其所处的正确位置时才会启动T细胞的扩增器角色,我认为这或许能作为一种特殊模型,而我们能在该模型的帮助下,以一种更有针对性的方式利用细胞疗法运输多种强大但有毒性的疗法制剂。
细胞疗法对于多种血液癌症的治疗非常有效,因为血液癌症中的癌细胞处于自由漂浮状态,且很容易获得,然而,实体瘤则会构建起多种防御屏障从而预防治疗性的T细胞进入其中,而且如果细胞无法进入到肿瘤中时,其往往在能够毁灭癌细胞之前就会变得疲惫不堪。从20世纪80年代开始,肿瘤学家一直都知道,高剂量的IL-2会促进T细胞克服这些屏障,而且细胞因子也能作为挑战这些癌症病例的新型癌症疗法,但简单地给予病人系统性地输注IL-2或许就会导致高烧、血管渗漏和器官衰竭。研究者Lim等人旨在通过工程化改造细胞来制服IL-2的效应,从而使得这些细胞只有在其被需要的地方(肿瘤中)来增强抗癌免疫反应。
【4】Nature:揭示经过基质金属蛋白酶裂解的I型胶原蛋白促进胰腺癌生长机制
doi:10.1038/s41586-022-05169-z
胰腺导管腺癌(PDAC)是最常见和最致命的胰腺癌形式。患有PDAC的病人的总体5年生存率仅为7.1%。所有的癌症都是不同的。PDAC的一个独特特征是肿瘤内广泛的结缔组织形成,这是由成纤维细胞和它们分泌的胞外基质对肿瘤块的浸润造成的。胞外基质的主要成分是I型胶原蛋白(type I collagen, Col 1),它是一种广泛存在在人体中的蛋白,形成骨骼、皮肤、血管和结缔组织的基本结构。Col 1对PDAC产生的影响及其对治疗的反应一直是科学家们激烈争论的问题:一些人认为Col 1促进了肿瘤的生长和扩散,另一些人则认为它限制了肿瘤的生长并保护癌细胞免受免疫攻击。
近日,一篇发表在国际杂志Nature上题为“Collagenolysis-dependent DDR1 signalling dictates pancreatic cancer outcome”的研究报告中,来自中国南京大学医学院附属鼓楼医院等机构的科学家们就通过研究解决了这个争论,表明重要的不是肿瘤中Col 1的数量,而是它的质量和性质。具体来说,他们报告说,被基质金属蛋白酶(分解诸如胶原蛋白之类的基质蛋白的酶)裂解的Col 1会刺激肿瘤生长,而完整和未裂解的Col 1会抑制肿瘤生长。Su说,“此外,裂解的Col 1通过与一种叫做DDR1的受体蛋白结合,激活了一种刺激胰腺癌细胞产生能量的信号通路。未裂解的Col 1通过诱导DDR1的降解来抑制这种信号通路。
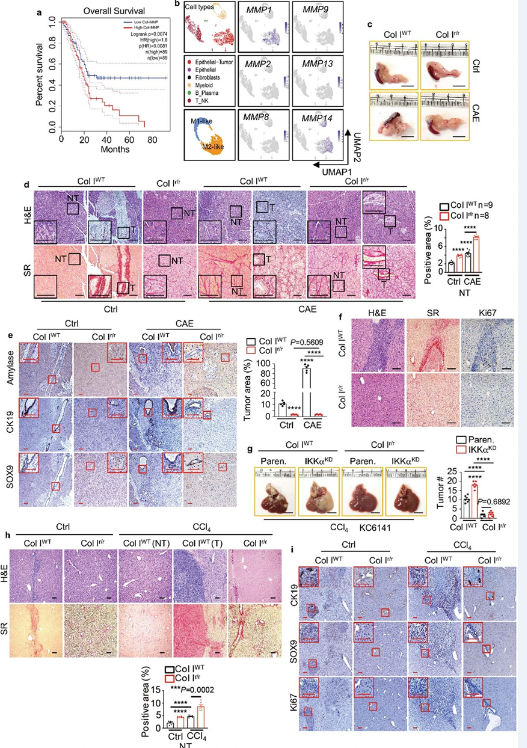
Col I裂解刺激PDAC生长。
图片来源:Nature, 2022, doi:10.1038/s41586-022-05169-z。
这项新的研究是利用小鼠模型和一种新的培养系统进行的,在这种培养系统中,PDAC细胞被放置在含有裂解或未裂解的Col 1的胞外基质上。这些作者说,这些发现具有重要的临床意义。人类PDAC基质或结缔组织中裂解的Col 1和未裂解的Col 1的相对数量强烈地影响着手术切除后的患者生存。肿瘤中富含裂解的Col 1且癌细胞表达高水平DDR1的患者预后很差,大多数人在手术后两年内就死于这种疾病。这一预后很差的患者群体占该研究分析的106名患者的75%,使用的是由Sun博士及其同事提供的癌症标本。
【5】Clin Cancer Res: 使用小分子抑制剂选择性靶向STAT3是治疗胰腺癌的一种潜在策略
doi:10.1158/1078-0432.CCR-22-0997
信号转导和转录激活因子3(STAT3)是一种潜在的细胞质转录因子,属于STAT家族蛋白。在细胞因子、生长因子等信号的刺激下,STAT3被结构性激活,支持肿瘤细胞的存活、生长、迁移、耐药和免疫逃避。STAT3信号通路的激活与疾病进展和预后不良密切相关,因此STAT3是肿瘤治疗的重要靶点。近日,来自华东师范大学的研究者们在Clin Cancer Res杂志上发表了题为“Selectively targeting STAT3 using a small molecule inhibitor is a potential therapeutic strategy for pancreatic cancer”的文章,该研究工作展示了一流的选择性STAT3抑制剂WB436B,作为治疗胰腺癌的潜在候选药物。
胰腺癌是人类所有癌症中预后最差的一种,迫切需要新的有效治疗方法。信号转导和转录激活子3(STAT3)已被证明是治疗胰腺癌的一个有前途的靶点。然而,选择性靶向小分子的STAT3仍然是一个具有挑战性的问题。研究者通过基于结构的虚拟筛选和直接结合实验,筛选出130多万个化合物,以确定STAT3抑制剂的特异性。通过诱导FIT分子对接模拟、Rosetta配基计算和定点突变对WB436B结合的氨基酸残基进行了验证。
另外,研究者通过微量热电泳法、表面等离子体共振法、体外激动法、RNA测序法和选择性细胞生长抑制法检测WB436B的靶向效应。在四种动物模型上进行体内研究,以评估WB436B对肿瘤生长和转移的影响。采用Kaplan-Meier分析评估存活率。与其他STAT家族蛋白相比,WB436B能选择性地与STAT3结合,体外抗肿瘤活性比具有代表性的STAT3抑制剂提高10-1000倍。WB436B选择性地抑制STAT3-Tyr705的磷酸化、STAT3靶基因的表达以及STAT3依赖的胰腺癌细胞的活力。
【6】Nat Cancer:揭示胰腺导管腺癌为了生存而相互合作背后的分子机制
doi:10.1038/s43018-022-00463-1
最常见的胰腺癌中的肿瘤细胞能共享营养物质来生存和生长,近日,一篇发表在国际杂志Nature Cancer上题为“Differential integrated stress response and asparagine production drive symbiosis and therapy resistance of pancreatic adenocarcinoma cells”的研究报告中,来自加利福尼亚大学等机构的科学家们通过进行为期4年的研究或有望帮助开发出治疗胰腺导管腺癌更好的疗法,胰腺导管腺癌在所有胰腺癌病例中占到了90%以上的比例,尽管胰腺癌相对罕见,但其是仍然是美国人群因癌症死亡的主要原因之一。
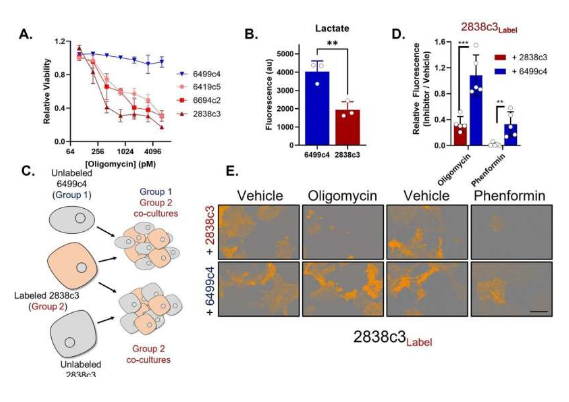
揭示胰腺导管腺癌为了生存而相互合作背后的分子机制。
图片来源:Nature Cancer (2022). DOI:10.1038/s43018-022-00463-1
目前科学家们在治疗胰腺导管腺癌上面临的一个挑战就是,其一般并不会表现出早期症状,而另一个障碍就是其密集和纤维状肿瘤的复杂性,因此,其在肿瘤中并没有完全功能性的血管,这或许就使得科学家有效使用化疗手段变得非常困难,然而,这也意味着,肿瘤会衍生出一种不同的代谢模式。研究者Christopher Halbrook说道,如果没有血管,胰腺导管腺癌细胞就无法获得其所需的正常营养,因此其就会想出很多其它的方式来滋养自己并进行生长,理解这一过程对于设计靶向作用癌症代谢的新型疗法至关重要。
研究者在肿瘤中发现了两类不同的胰腺导管腺癌细胞,每一种都拥有不同的代谢过程,这种不同的程序就会促使其互相交换营养,因此其彼此就能得到所需要的的东西;研究者发现,其中一类癌细胞对于线粒体“毒药”非常敏感,这些“毒药”通常用作癌症疗法,然而其在从另一类细胞中所获得的的名为天冬氨酸的氨基酸的帮助下就能得以生存,而这种细胞有很多东西能够进行分享,因为其会过量产生天冬氨酸从而对持续性的压力产生反应。
【7】Cancer Discov:一种新型的抗KARS药物或有望治疗人类胰腺导管腺癌
doi:10.1158/2159-8290.CD-22-1066
在超过90%以上的胰腺导管腺癌(PDAC)患者中都存在KRAS癌基因的突变,其中Gly到Asp的突变(KRASG12D)最为常见。近日,一篇发表在国际杂志Cancer Discovery上题为“Efficacy of a small molecule inhibitor of KrasG12D in immunocompetent models of pancreatic cancer”的研究报告中,来自宾夕法尼亚大学等机构的科学家们通过研究发现,一种攻击难以靶向作用的致癌基因突变KRAS(在近乎30%的人类癌症中都存在)的小分子抑制剂或能成功促进胰腺癌临床前模型机体中的肿瘤萎缩并阻断癌症的生长,这种药物分子或许能作为后期科学家们开展临床试验的强有力的候选药物。
研究者Ben Stanger博士表示,这项研究结果与我们此前在胰腺癌研究中所观察到的结果形成了鲜明的对比,即使在这类癌症的临床前研究模型中,在过去十年里所检测的大多数药物(包括新型免疫疗法)都产生了有限的影响。胰腺癌患者的整体预后不佳,其5年生存率仅为11%,而且疗法往往非常有限;近乎90%的胰腺癌都是由KRAS突变所引起的,KRAS是人类多种癌症类型中最常见的癌基因,首个针对KRAS的靶向性疗法去年获批用于治疗携带KRAS G12C突变的非小细胞肺癌患者,但仅有2%的胰腺癌会表达这类突变,大约36%的携带KRAS突变的胰腺癌都是KRAS G12D的突变类型。
这项研究中,研究人员使用Mirati Therapeutics公司所开发的MRTX1133小分子抑制剂能特异性地靶向作用KRAS G12D,上个月,该公司的研究人员在Nature Medicine杂志上发表文章阐述了这种小分子抑制剂的作用机制;如今,他们发现,KRAS抑制剂不仅能直接靶向作用癌细胞,还能意外地与机体免疫系统相互作用从而产生一种持久的治疗反应,这一点非常重要,因为癌症最终会找到一种方法来逃避大多数的靶向性治疗。
【8】Adv Sci:揭示特殊细胞因子在KRAS驱动的胰腺导管腺癌发生过程中扮演的关键角色
doi:10.1002/advs.202202448
鸟嘌呤核苷酸交换因子(GEF,guanine nucleotide exchange factors)SOS1能催化RAS上的GDP与GTP的交换,然而,研究人员并不清楚GEF活性调节是如何发生的。近日,一篇发表在国际杂志Advanced Science上题为“PPDPF Promotes the Development of Mutant KRAS‐Driven Pancreatic Ductal Adenocarcinoma by Regulating the GEF Activity of SOS1”的研究报告中,来自中科院上海营养与健康研究所等机构的科学家们通过研究揭示了胰腺组细胞分化和增殖因子(PPDPF)在胰腺导管腺癌发生过程中扮演的关键角色,同时还提出了一种治疗胰腺导管腺癌的潜在治疗性策略。
胰腺导管腺癌是全球癌症引起人群死亡的第六大原因,胰腺癌患者的5年总体存活率不到5%,由高达98%的胰腺导管腺癌都存在KRAS的突变,诸如SOS1等RAS鸟嘌呤核苷酸交换因子(GEF)能被招募到细胞质膜上,并催化RAS上GDP与GTP的交换,从而在EGFR激活时开启信号的表达,此前研究结果表明,GEF能结合GTP,然而,研究人员并不清楚GTP的结合对于GEF的重要性以及是否SOS1能结合GTP。
PPDPF首先在斑马鱼中被报道,其是一种外分泌细胞调节子,其含有潜在的PDZ, SH2, SH3结构域结合位点以及一种GTP结合位点,然而,PPDPF在胰腺癌中的生物学功能研究人员并不清楚;这项研究中,研究者发现,PPDPF的表达会在胰腺癌中增加,而且携带高水平PPDPF表达的患者往往预后较差;在KRAS突变驱动的胰腺导管腺癌小鼠模型中,敲除PPDPF或能明显抑制肿瘤的发育。
【9】Cancer Discov:应激颗粒或能驱动肥胖相关的胰腺癌的发生
doi:10.1158/2159-8290.CD-21-1672
肥胖是已知的至少13种癌症的风险因素,部分是因为其会在机体中制造无处不在的炎性状态,多年来科学家们一直想知道除了炎症之外是否还有更多的故事;近日,一篇发表在国际杂志Cancer Discovery上题为“Stress Granules Determine the Development of Obesity-Associated Pancreatic Cancer”的研究报告中,来自托马斯杰斐逊大学等机构的科学家们通过研究发现了肥胖驱动胰腺癌发生的新型分子机制,研究者表示,相比非肥胖的胰腺癌患者而言,应激颗粒(stress granules)在肥胖相关的胰腺癌患者中的水平或许更高,重要的是,阻断应激颗粒的形成或许会阻断动物机体中癌症的生长,同时本文研究还为开发新型抗癌疗法指明了新的方向。
研究者表示,大多数胰腺癌患者的5年生存率仅为11%,近年来关于应激颗粒的研究层出不穷,但关于其由什么组成的,以及其是如何发挥作用的,研究人员尚不清楚。本文研究结果首次表明,应激颗粒的超载或许会使得胰腺中的肿瘤生长,而通过对小鼠进行研究后,研究者也在实验室中完全逆转了小鼠机体中癌症的生长。
应激颗粒是一种不寻常的细胞区室(cellular compartment),细胞能产生这些非膜化的细胞器来应对压力,并能保护细胞免于压力诱导的自我毁灭过程,这是一种细胞反射和防御机制,其存在于整个动物和植物王国中;甚至西红柿也能产生应激颗粒来保护细胞免于损伤,然而研究人员并不知晓这些细胞器是由什么所组成的以及其如何保护细胞;很显然,癌症已经将这种防御机制转变成了自身的优势,很多癌症能产生比正常细胞更高水平的应激颗粒,从而来保护癌细胞免于诱发自然的自我毁灭过程。
【10】Cancer Cell:肿瘤微生物组的相互作用或能帮助识别胰腺癌新型疗法
doi:10.1016/j.ccell.2022.09.009
在多种癌症类型中都能检测到微生物,包括在假定的无菌器官中,但其如何影响致癌机制以及人类机体中的抗肿瘤反应,目前研究人员并不清楚。近日,一篇发表在国际杂志Cancer Cell上题为“Tumor microbiome links cellular programs and immunity in pancreatic cancer”的研究报告中,来自美国罗格斯大学等机构的科学家们通过研究分析了胰腺肿瘤的微生物组特征,并在单细胞分辨率下识别出了特定的微生物或与机体炎症和患者生存率有关。
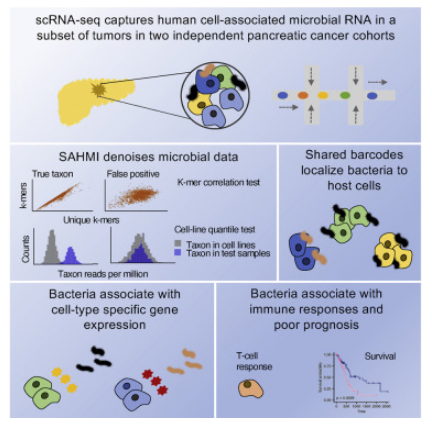
肿瘤微生物组的相互作用或能帮助识别胰腺癌新型疗法。
图片来源:Cancer Cell (2022). DOI: 10.1016/j.ccell.2022.09.009
据研究者介绍,这些微生物或许有望作为胰腺癌早期诊断和治疗的新型靶点,在美国,胰腺癌是人群癌症相关死亡的第四大原因。微生物是无法用肉眼看到的非常小的生物体,我们机体中生存的微生物的数量要比人类细胞的总量还要多,而且在诸如胰腺等器官中也会存在相应的微生物,而胰腺曾经一度被认为是没有微生物的。研究者Subhajyoti De说道,这项研究中,我们开始深入研究是否胰腺肿瘤中会定植某些微生物,以及是否其会影响癌症的进展和疗法的治疗,然而,研究肿瘤中的微生物非常困难,部分原因是每名患者都不一样,而且因为微生物的足迹非常细微,通常无法对其进行可靠地检测。
为了进一步研究,研究人员通力合作开发出了一种名为SAHMI(宿主-微生物组互作单细胞分析,Single-cell analysis of Host-Microbiome Interactions)的基因组方法来识别与单一人类细胞相关的微生物,利用复杂的软件对数百万条RNA序列进行筛选,研究人员就能识别出哪些可能会代表人类的基因,以及哪些是源自微生物的基因。研究者De说道,这种新技术就能促进我们识别出与肿瘤相关的微生物,并同时测定宿主细胞的活性,这或许就是一项重大的技术进步,其结果令人惊叹。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


