全球首个液体活检指导ROS1靶向药治疗非小细胞肺癌的数据发布
来源:奇点糕 2022-06-10 13:22
LBA501-LUMINA研究:T1N0管腔A型乳腺癌保乳手术后去放疗的前瞻性试验
LBA501-LUMINA研究:T1N0管腔A型乳腺癌保乳手术后去放疗的前瞻性试验
早期乳腺癌患者保乳手术(BCS)后,通常会辅助放射治疗(RT),以降低局部复发(LR)的风险。然而,这种治疗方法不仅费用昂贵且不方便,并伴有急性和晚期毒性。单靠传统的临床病理因素(CPF),很难识别出局部复发风险低到可以免于放疗的那部分患者。
已有研究显示,分子分型中管腔A型复发风险最低;对先前试验的回顾性分析表明,60岁以上的管腔A型1-2级T1N0 BC患者接受BCS和内分泌治疗后局部复发风险较低。目前,尚未有前瞻性研究评估CPF结合管腔A亚型指导RT决策的能力。
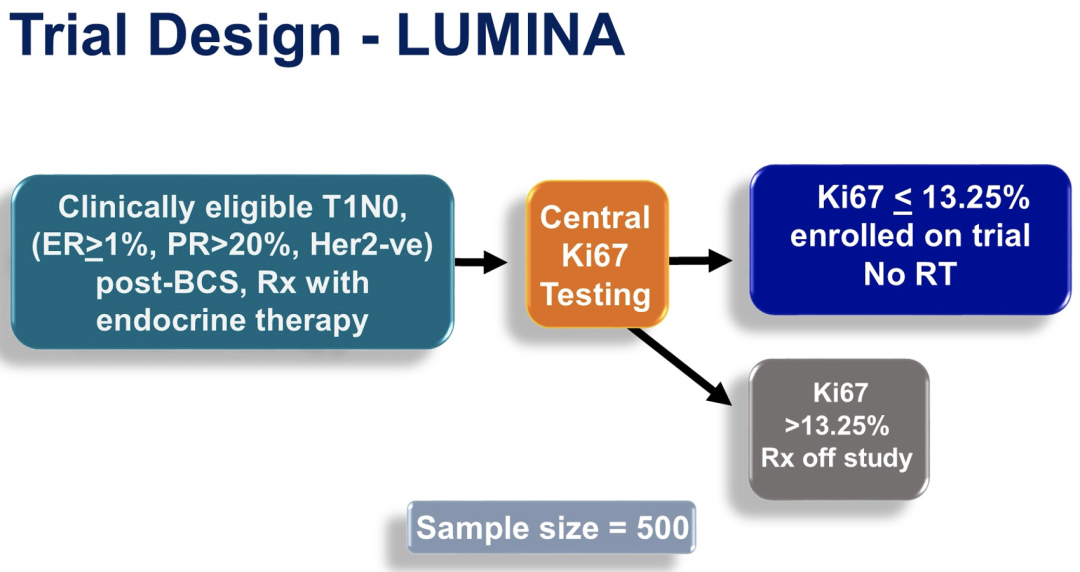
来自加拿大的Timothy Joseph Whelan教授等人进行了一项前瞻性、多中心队列研究。纳入标准为:≥55岁女性,已完成保乳手术的1-2级T1N0 BC患者,切除边缘≥1mm;管腔A亚型(定义为:ER≥1%,PR>20%,HER2阴性,Ki67≤13.25%);并辅助内分泌治疗。ER(雌激素受体)、PR(孕激素受体)和HER2(人表皮生长因子受体2)表达情况根据ASCO指南在当地进行评估。
符合临床纳入标准,且ER≥1%、PR>20%、HER2阴性乳腺癌患者被登记,并使用国际Ki67工作组认可的检测方法,在加拿大三大中心实验室中的一个进行Ki67免疫组化染色,每年进行实验室间的质量评估。Ki67≤13.25%的患者中被纳入试验,并被分配不接受RT治疗。
研究的主要结局是LR的时间(定义为从入组到发现同侧乳腺中任何浸润性或非浸润性癌症的时间)。假设5年LR率为3.5%,至少需要500名患者的样本量,在双侧可信区间(CI)为90%(单侧为CI95%)的情况下得出<5%的显著差异。患者在前两年每六个月随访一次,然后每年随访一次。使用死亡作为竞争风险模型的累积发病率函数估计LR的概率。次要结局为对侧乳腺出现肿瘤的时间;无复发生存期(RFS);基于任何复发、第二次癌症或死亡的无病生存期(DFS);和总生存期(OS)。
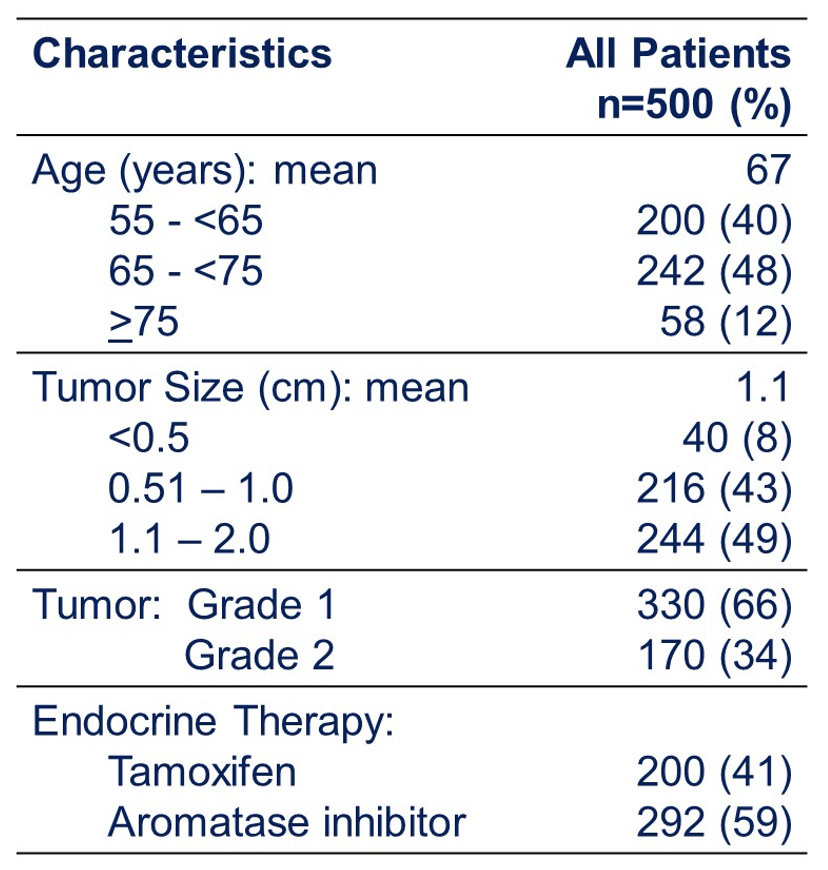
在2013年8月至2017年7月之间,来自26个中心的727名登记患者中有501名患者的Ki67≤13.25%,并被纳入研究。中位随访时间为5年,中位年龄为67岁,其中442名(88%)患者的年龄<75岁。肿瘤的平均大小为1.1厘米。5年的LR率满足预期。

这项研究表明,≥55岁1-2级T1N0管腔A型女性乳腺癌患者,接受保乳手术后辅助内分泌治疗,5年时局部复发风险非常低,可以免于放疗。
LBA5004-恩扎卢胺治疗转移性激素敏感性前列腺癌(mHSPC)的国际合作组试验ENZAMET(ANZUP1304)最新总生存期结果
ENZAMET的首次计划中期分析表明,在34个月的中位随访期之后,出现243例死亡病例,表明恩扎卢胺联合标准疗法治疗mHSPC带来的总生存期受益具有临床意义(HR=0.67,95%CI 0.52-0.86,p=0.002)。澳大利亚莫纳什大学的研究人员发布了出现470例死亡病例后所进行的预定分析的最新OS结果。
这个研究将mHSPC患者随机分成两组,分别接受睾酮抑制(TS)联合非甾体类抗雄性激素(NSAA)药物或者恩扎卢胺治疗。分组因素包括年龄、瘤荷(高 vs 低,根据CHAARTED定义分组),以及由主治医师指定的是否计划同时接受多西他赛治疗。
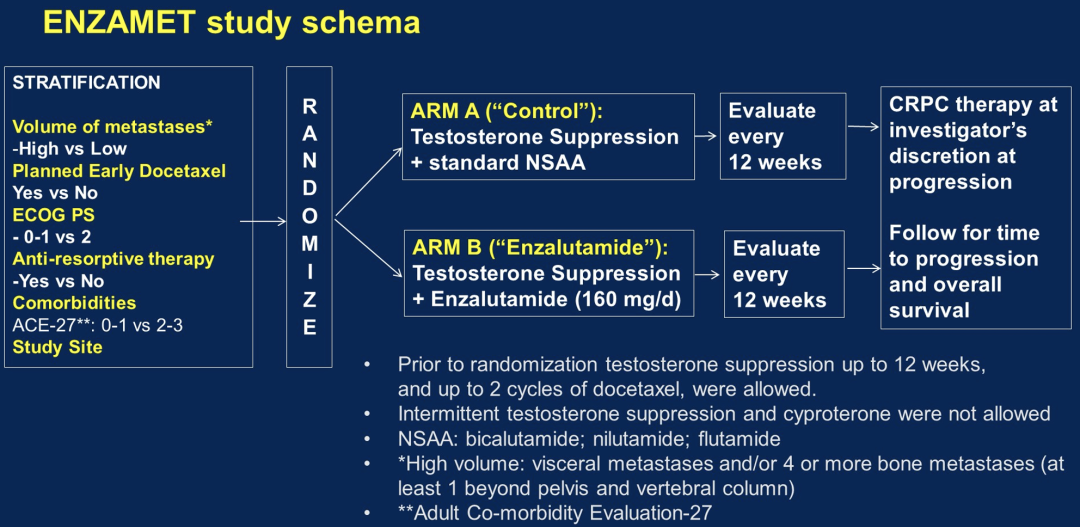
1125例患者进行了随机分组,中位年龄为69岁,其中503例患者同时还接受多西他赛治疗,602患者有较高转移瘤荷。下表中的OS是基于476例死亡病例的分析结果,这些患者的中位随访时间为68个月,截止日期为2022年1月19日。与对照相比,所有接受恩扎卢胺治疗的患者的死亡风险降低了30%(p=0.0001)。表中展示了根据瘤荷状态,以及同时接受多西他赛治疗的M1高瘤荷和低瘤荷分组的结果。
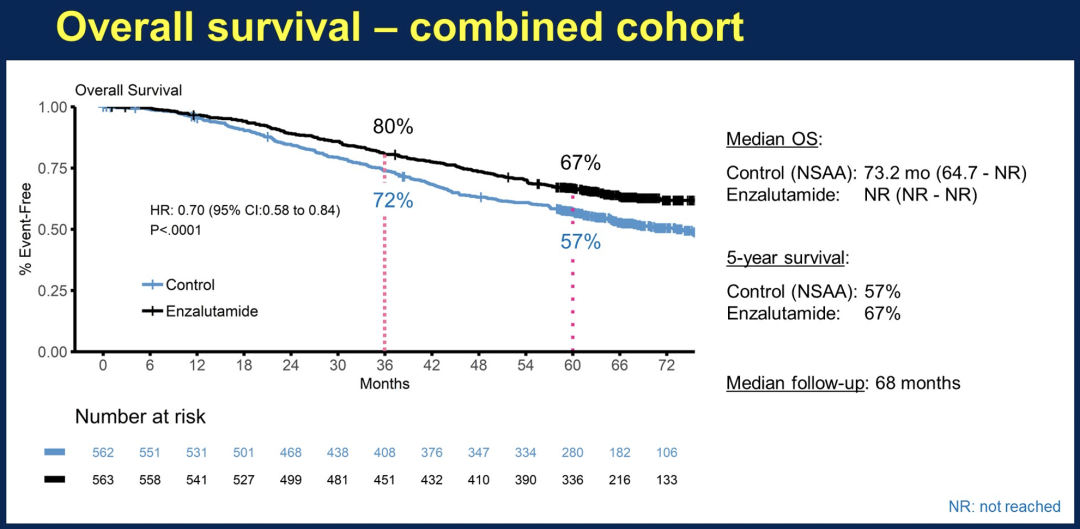
与NSAA相比,恩扎卢胺联合TS在合并的总体队列中带来了具有临床意义的OS延长,在额外的三年随访时间里,这种获益持续存在。尽管TS+多西他赛+NSAA组的患者生存期相对较长,但低瘤荷患者的OS获益更为显著,不过在M1高瘤荷患者中也观察到OS受益。
LBA5500-ATHENA-MONO研究:rucaparib单药用于一线铂类化疗缓解的卵巢癌患者维持治疗疗效显著
聚腺苷二磷酸核糖聚合酶(PARP)抑制剂对卵巢癌(OC)患者一线维持治疗显示出有效性,但可能从中获益的人群仍不明确。
Bradley J. Monk教授等人开展的ATHENA-MONO研究,旨在评估rucaparib单药用于广泛性卵巢癌患者作为一线维持治疗的有效性,包括没有发生BRCA突变或其他同源重组缺陷(HRD)或高风险临床特征(如残留疾病)的人群。在本次大会上,研究人员报告了rucaparib对比安慰剂作为卵巢癌一线维持治疗的疗效。
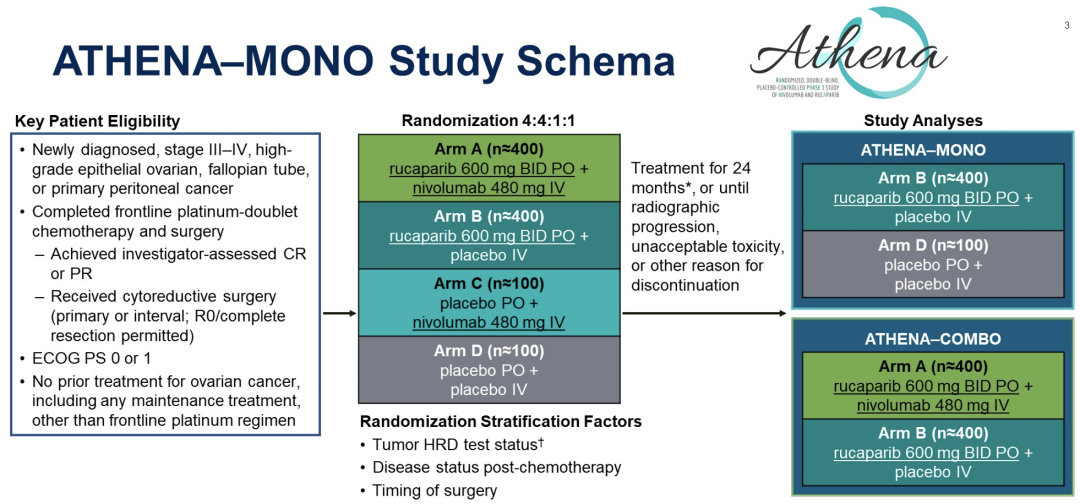
研究的纳入标准为已完成肿瘤细胞减灭术(包括R0水平)和一线含铂双药化疗(包括含贝伐珠单抗的化疗方案)后缓解的III-IV期高级别OC患者,入组患者按4:1被随机分为两组,一组口服rucaparib(600mg BID),另一组使用安慰剂。
根据HRD状态(使用FoundationOne CDx检测确定),化疗后肿瘤残余情况和手术时机对患者进行分层。主要终点为,在HRD人群(BRCA突变或BRCA野生型/杂合性缺失LOH高)和意向治疗(ITT)人群中,研究者根据RECIST评估的无进展生存期(PFS)。盲法独立中心审查(BICR)评估的PFS是一个独立的次要终点。BRCA突变和HRD阴性患者(BRCA野生型/LOH低)的PFS是探索性终点。
截至2022年3月23日,427名和111名患者被随机分到rucaparib单药治疗组和安慰剂组(中位治疗时间分别为14.7和9.9个月)。PFS数据如下图所示。

最常见的3级治疗引发的不良事件(TEAE)是贫血(rucaparib组28.7%,安慰剂组0%),中性粒细胞减少(rucaparib组14.6%,安慰剂组0.9%),转氨酶(ALT/AST)升高(rucaparib组10.6%,安慰剂组0.9%)。患者因TEAE导致的rucaparib剂量减少、中断和停药的发生率分别为:49.4%、60.7%和11.8%。
这项研究表明,与安慰剂相比,rucaparib单药一线维持治疗,在ITT和HRD阳性人群以及HRD状态未知的亚组患者中观察到明显的临床获益。
LBA5504-MITO23研究:trabectedin(ET-743)单药与临床医生选择的化疗方案,治疗BRCA突变或BRCAness表型的复发性卵巢癌、原发性腹膜癌或输卵管癌患者的随机III期试验
Trabectedin单药用于复发性铂敏感卵巢癌患者(OC)显示出良好的抗肿瘤活性,总缓解率(ORR)为26%-43%,中位无进展生存期(PFS)为5个月。此外,在一项单臂2期试验中,trabectedin治疗BRCA突变和/或BRCAness表型复发性OC患者的缓解率(RR)为39.4%、中位无进展生存期(PFS)为4.5个月、中位总生存期(OS)为18个月。
MITO23研究是一项开放性、III期随机试验,纳入标准为BRCA 1/2突变或BRCAness表型的复发性OC患者(定义为之前接受过至少2次铂基治疗并对其有响应),入组患者随机分为两组,实验组接受trabectedin 1.3 mg/mq q 21d,对照组接受临床医生选择的化疗方案(可选方案:卡铂、吉西他滨、紫杉醇周疗、聚乙二醇化阿霉素脂质体或托泊替康)。
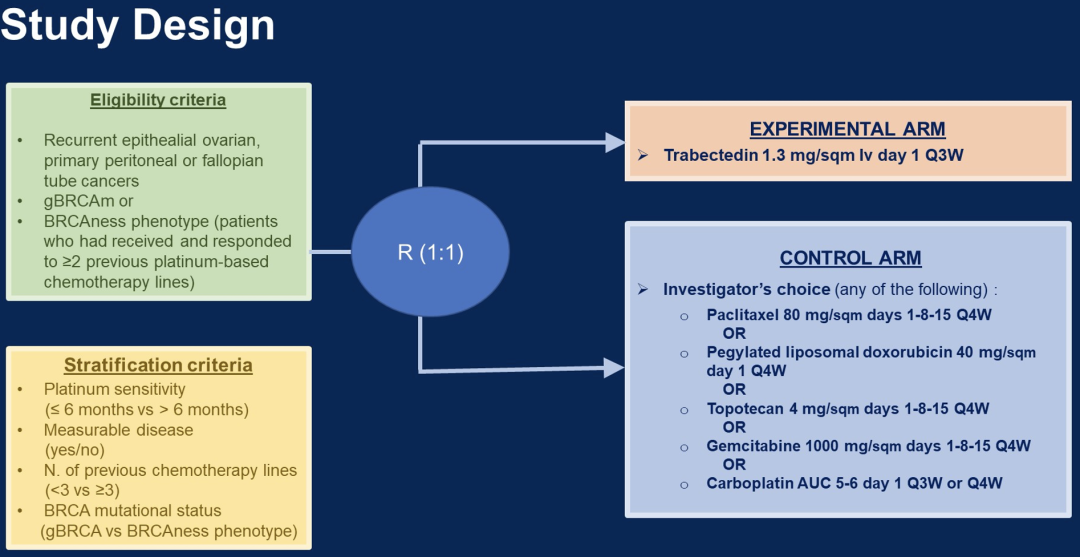
研究的主要终点是OS,次要终点为PFS、ORR和反应持续时间(DoR)。样本量的计算基于trabectedin将中位OS从10个月增加到15个月的假设(双侧对数秩检验,误差为0.05,检验把握度为80%)。使用Kaplan-Meier方法计算中值和生命表,并使用对数秩检验进行分析,Cox比例风险模型用于评估治疗效果。
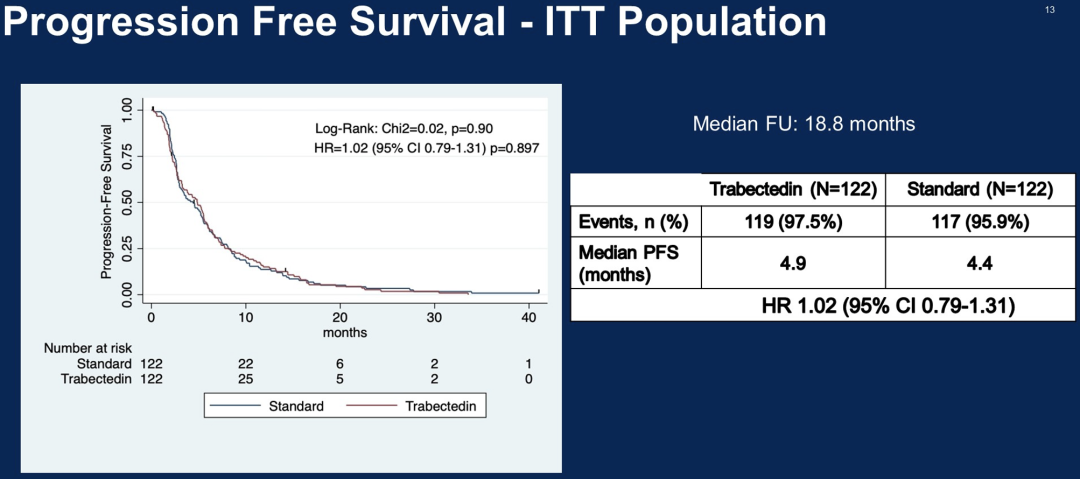
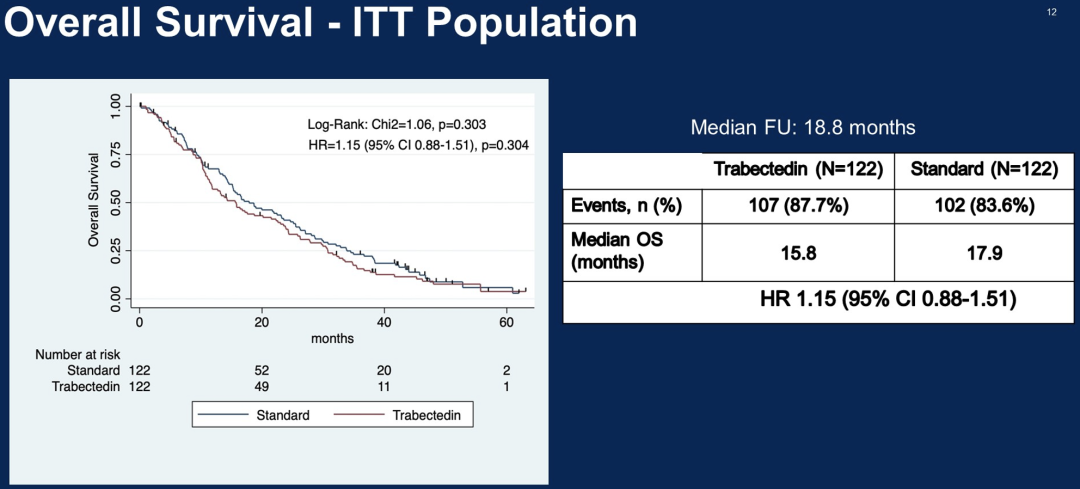
244名患者根据意向治疗原则进行随机分析。中位随访时间为40个月时,对照组和试验组患者的中位PFS分别为4.4和4.9个月(风险比为1.03, p =0.848),中位OS分别为17.9和15.8个月(风险比为1.15, p= 0.304)。
接受标准化疗的患者ORR为20.2%,接受trabectedin治疗的患者ORR为15.4%。根据BRCA突变状态、化疗类型和无铂间隔时间,在预先指定的亚组分析中,trabectedin没有显示出更好的疗效。所有化疗方案均未发现新的毒性反应。
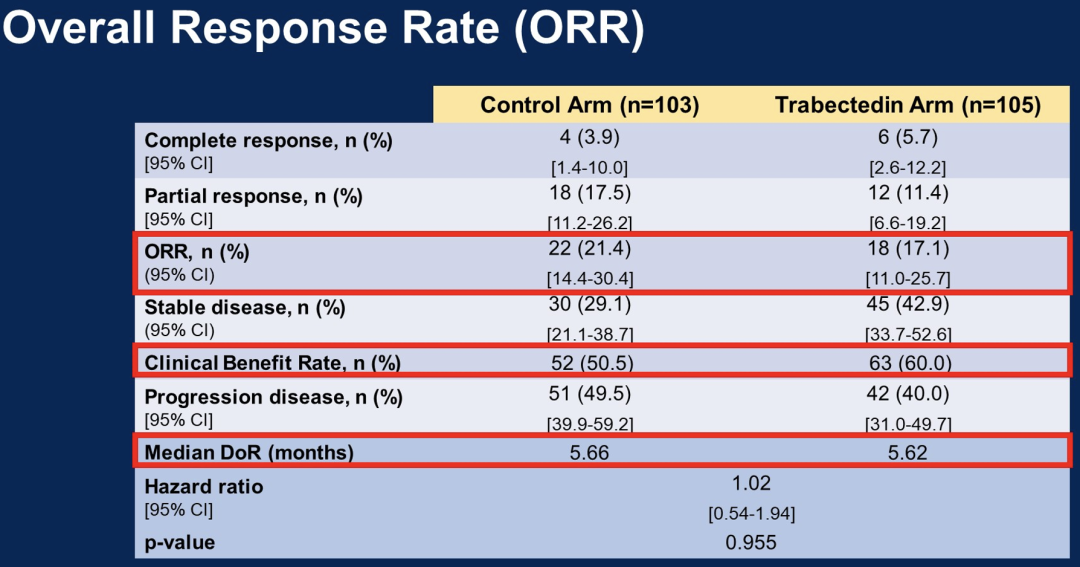
这项研究表明,与标准化疗相比trabectedin单药治疗BRCA突变和BRCAness表型OC患者,不能改善生存结果。
LBA6016-一项评估添加低剂量纳武利尤单抗,在头颈癌姑息化疗中作用的临床3期随机对照研究
在低收入和中等收入国家,由于费用问题,只有1%-3%的患者能够获得批准用于治疗晚期头颈部鳞状细胞癌(HNSCC)的方案。在印度Tata纪念中心Vijay Maruti Patil团队之前的研究中,节拍化疗(MC)提高了这种情况下的生存率。回顾性数据表明低剂量的纳武利尤单抗可能是有效的。因此,这个研究旨在评估在MC中加入低剂量的纳武利尤单抗是否能提高总生存率。
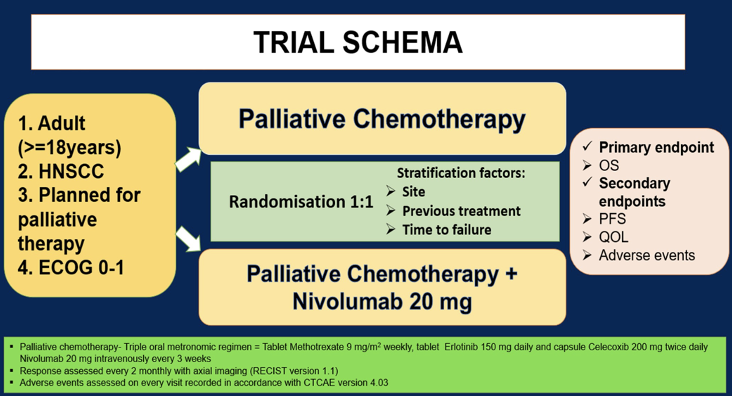
这是一项随机的3期优效性、开放标签研究。ECOG PS 0-1,接受姑息性治疗的复发性或新诊断的晚期HNSCC成年患者符合入组标准。将患者以1:1的比例随机分配至MC组,包括甲氨蝶呤15 mg/㎡口服每周一次、塞来昔布200 mg口服每天一次和厄洛替尼150 mg口服每天一次,或MC-I组,即MC化疗联合纳武利尤单抗20 mg静脉注射每3周一次。治疗持续到疾病进展或不可耐受的不良事件。每2个月进行一次疗效评估[根据实体瘤疗效评估标准(RECIST)1.1版]。主要终点是1年总生存期(OS),预先设定的中期分析的疗效的p值为0.006。
151例患者随机分组,MC组75例,MC-I组76例。添加低剂量纳武利尤单抗使1年总生存率从16.3%(95%CI 7.95-27.4)提高到43.4%(95%CI 30.8-52.3)[风险比(HR)0.545;95%CI 0.362-0.82;P=0.00358]。MC组和MC-I组的中位总生存期分别为6.7个月(95%CI 5.83-8.07)和10.1个月(95%CI 7.37-12.63)(P = 0.0052)。
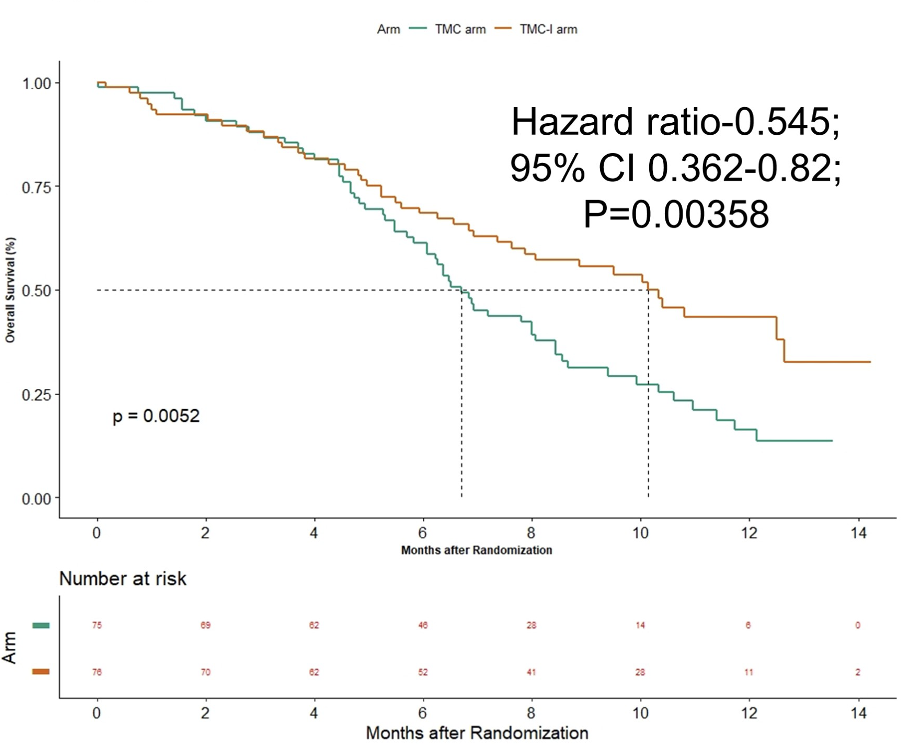
MC组和MC-I组的中位无进展生存期分别为4.57个月(95%CI 4.2-5.3)和6.57个月(95%CI 4.43-8.9)(P = 0.0021)。MC组和MC-I组的缓解率分别为49.3%(95%CI 37.8-60.8)和65.2%(95%CI 53.4-75.4)(P = 0.085)。MC组和MC-I组3级及以上不良事件发生率分别为50%和46.1%(P = 0.744)。
这是首次在随机研究中证明,添加低剂量纳武利尤单抗可提高总生存率,这将成为不能获得全剂量纳武利尤单抗患者的替代治疗标准。
LBA8507-SKYSCRAPER-02研究:在初治的广泛期小细胞肺癌患者(pts)中,阿替利珠单抗(atezo)+卡铂+依托泊苷(CE)联合或不联合tiragolumab(tira)的III期,随机,双盲,安慰剂对照临床研究的主要结果
Atezo与CE联合疗法是第一个批准用于ES-SCLC一线治疗的免疫疗法。然而,大多数患者最终会出现疾病进展。TIGIT是一种存在于活化的T细胞和NK细胞上的新型抑制性免疫检查点。Tira(抗TIGIT)可能与其他免疫疗法如PD-L1/PD-1抑制剂具有协同作用,并进一步放大免疫应答从而改善临床结果。SKYSCRAPER-02研究(NCT04256421)评估了在ES-SCLC患者中,atezo+CE疗法增加tira,是否增强其抗肿瘤作用和生存获益。
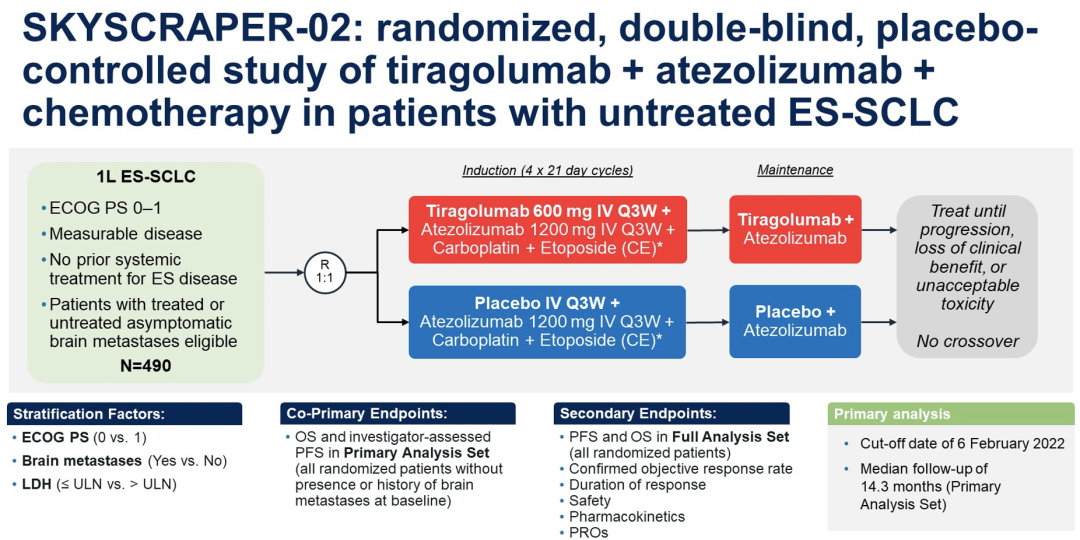
符合标准的初治ES-SCLC(允许纳入无症状治疗或未治疗的脑转移瘤[BM]患者)患者按1:1随机接受tira 600 mg IV或安慰剂(pbo)联合atezo 1200 mg IV+CE,21天每周期*4周期的诱导治疗,然后使用tira或安慰剂联合atezo维持治疗,3周每次,直至疾病进展或丧失临床获益。分层因素包括ECOG PS(0 vs 1);BM的存在/病史(是vs否);乳酸脱氢酶(≤正常上限[ULN]与>ULN)。共同主要终点是在基线时没有BM的病史/存在的所有随机患者(主要分析集[PAS])中,研究者评估的PFS和OS。其他终点包括所有随机患者的PFS和OS,无论BM状态如何(全分析集[FAS]),以及客观缓解率,缓解持续时间和安全性。

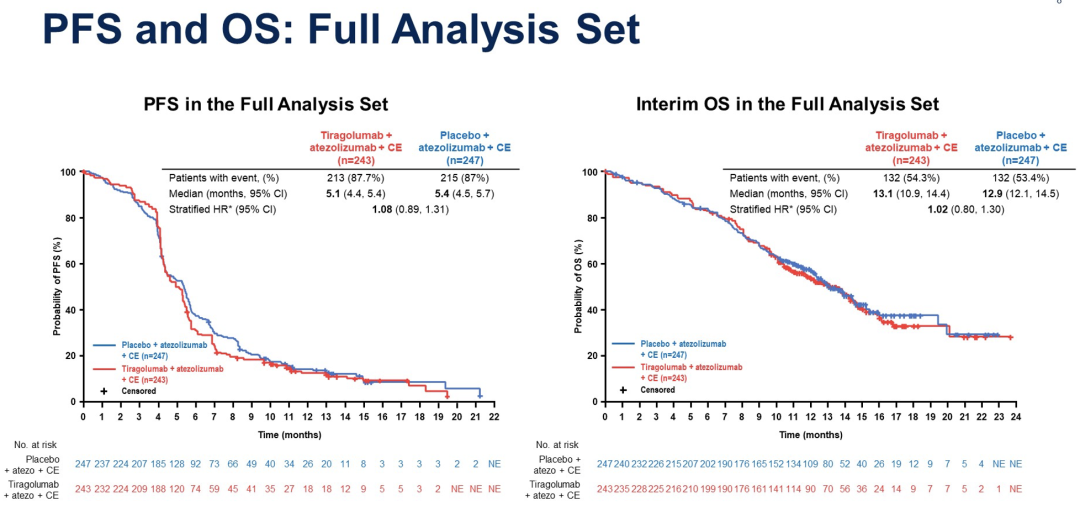
共490例患者接受随机分组(tira+atezo+CE,n=243;pbo+atezo+CE,n=247)。截至2022年2月6日,中位随访时间为13.9个月(mo);数据呈现了PFS的最终分析结果和OS的中期分析结果。
在PAS中,与pbo+atezo+CE相比,tira+atezo+CE没有额外的PFS或OS获益。FAS中的PFS和OS与PAS中观察到的一致。
3/4级TRAEs发生率分别为52.3%(tira+atezo+CE)和55.7%(pbo+atezo+CE),5级TRAEs发生率分别为0.4%(tira+atezo+CE)和2.0%(pbo+atezo+CE)。tira+atezo+CE和pbo+atezo+CE中,导致任何治疗终止的TRAEs发生率分别为的5.0%和5.3%。
在伴或不伴脑转移的初治广泛期非小细胞肺癌患者,atezo+CE联合tira并未提供优于atezo+CE的获益。该组合耐受性良好,未发现新的安全信号。该研究将继续进行至原计划的最终OS分析。
LBA8511-可切除(IB-IIIA期)非小细胞肺癌(NSCLC)新辅助治疗中,纳武利尤单抗(NIVO)联合含铂双药化疗(chemo)对比单纯化疗:CheckMate 816研究中病理退缩与无事件生存(EFS)的关联性
研究表明,作为新辅助治疗临床试验中常见的疗效终点,病理反应与包括可切除NSCLC在内的各种肿瘤患者接受化疗时的生存相关。然而,病理完全缓解(pCR)与生存之间,以及与可预测新辅助免疫治疗EFS的病理退缩程度之间的关联性尚未得到严格证实。CheckMate 816(NCT02998528)是一项在可切除NSCLC新辅助治疗中比较NIVO+化疗与化疗的随机3期研究,本研究在EFS和pCR方面具有统计学意义和临床意义的改善,达到其两个主要研究终点。在此,我们报告了CheckMate 816研究中病理退缩和EFS关联性的事后分析。
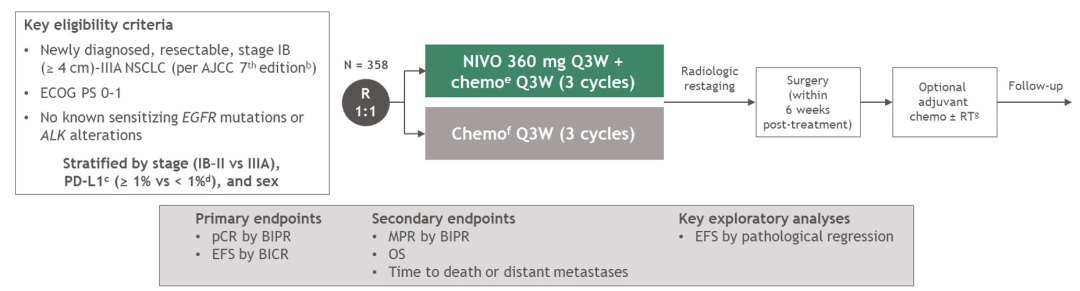
将可切除成人NSCLC患者随机分成两组,分为接受3个周期NIVO 360 mg+含铂双药化疗Q3W或单独化疗Q3W。主要研究终点是EFS和pCR(基于免疫相关病理反应标准,原发肿瘤[PT]和淋巴结[LN]中无任何残留活肿瘤[RVT]),均由盲法独立评估委员会进行评估。主要病理反应(MPR,PT和LN中RVT百分比不超过10%)是次要终点。在该事后分析中,仅在PT中基于病理学退缩深度(通过测量RVT百分比)评估EFS。此外,使用时间依赖性受试者工作特征曲线分析评估了RVT百分比(仅PT)对2年EFS结果的预测能力,使用曲线下面积(AUC)评估总体诊断准确性(0.5=随机机会;1=100%准确性)。
NIVO+化疗组和化疗组中,具有病理学可评估样本患者的基线特征平衡良好,且与总体人群相似。两组中,与没有达到pCR或MPR的患者相比,达到的患者EFS(最小随访时间,21个月)均得到改善(见表)。
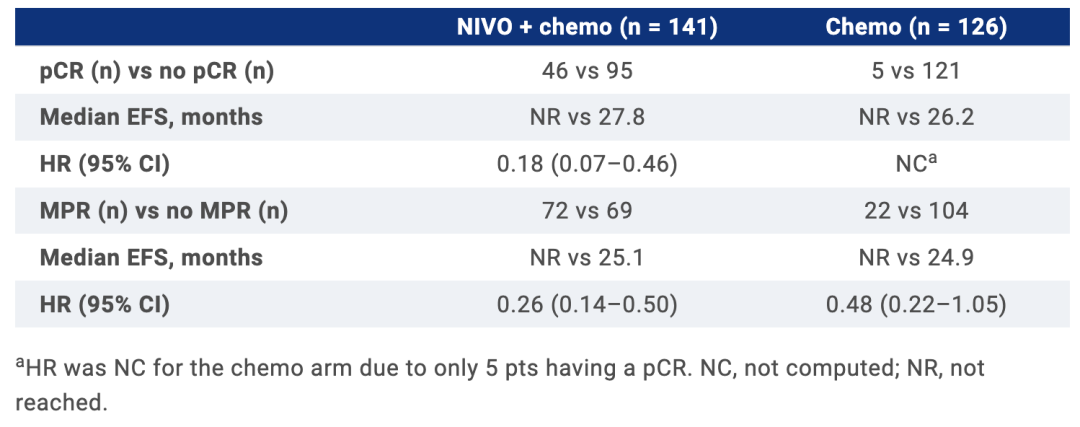
RVT百分比似乎可以预测NIVO+化疗组2年的EFS(AUC=0.74),但在化疗组中,其与EFS的的相关性(AUC=0.54)尚不明确。NIVO+chemo组中,0-5%,>5-30%,>30-80%和>80%RVT患者的2年EFS率分别为90%,60%,57%和39%。
在CheckMate 816研究中,NIVO+化疗新辅助治疗组原发肿瘤的病理反应(pCR和MPR)与改善的EFS相关。此外,病理退缩的深度似乎可以预测EFS的改善。
LBA9009-adagrasib(MRTX 849)在KRAS G12C突变的NSCLC和活动性未治的CNS转移患者中的活性:KRYSTAL-1研究
27%–42%携带KRAS G12C突变的非小细胞肺癌(NSCLC)发生中枢神经系统(CNS)转移(mets)且预后不良。研究药物Adagrasib(Ada)是一种KRAS G12C抑制剂,不可逆地选择性结合KRAS G12C,将其锁定在非活性状态,并针对有利的PK特性进行了优化,包括长半衰期(约24h)和剂量依赖性PK。在CNS转移的临床前模型中,Ada显示了剂量依赖性CNS渗透和颅内(IC)肿瘤消缩。
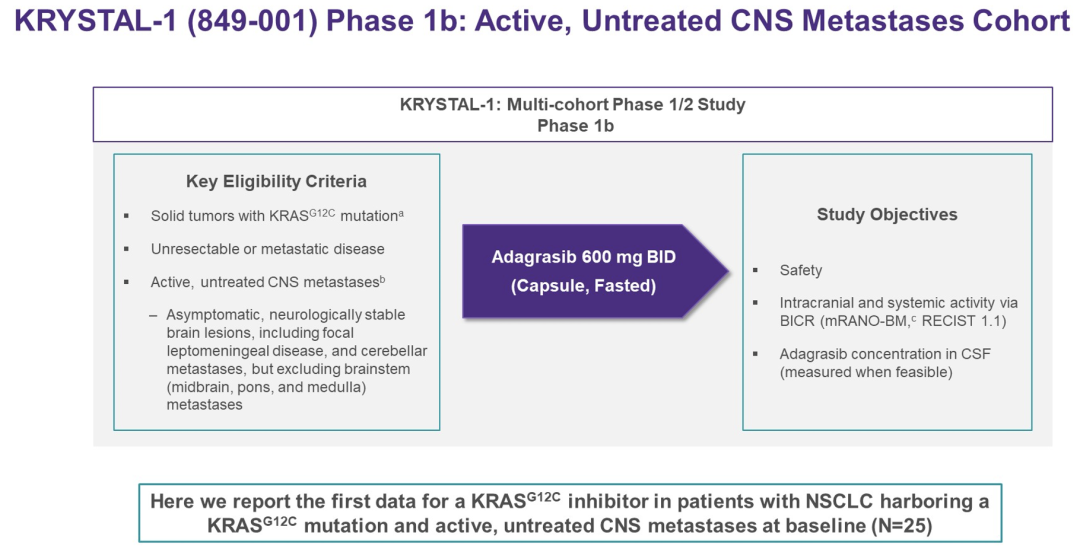
KRYSTAL-1(NCT03785249)是一项多队列1/2期研究,评估Ada作为单药治疗或与经选的药物联合治疗KRAS G12C突变晚期实体瘤患者。在1b期队列中,患有KRAS G12C突变NSCLC和活动性未治CNS mets的患者接受Ada 600 mg BID治疗。
这项1b期队列的目的是评估安全性和临床活性,包括通过盲法独立中心审查(BICR)评估的系统和颅内客观缓解率(ORR)、缓解持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)。通过实体瘤疗效评价标准(RECIST)1.1评估系统缓解;颅内缓解通过改良的RANO标准和IC RECIST进行评估。尽可能收集脑脊液(CSF),用于测量Ada浓度以进行选择性评估。
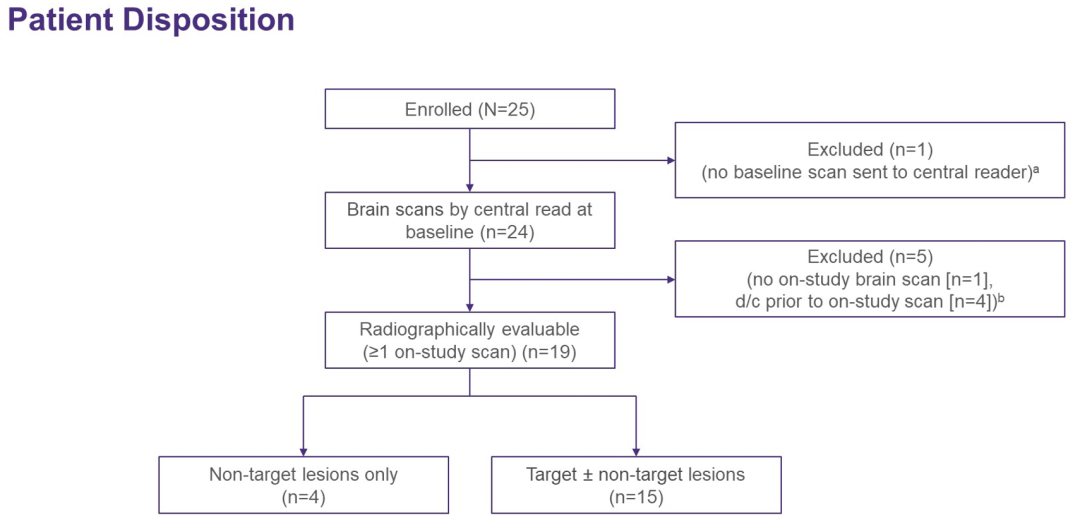
截至2021年12月31日,25例NSCLC患者入组并接受治疗。截止日期时的中位随访时间为6.6个月。中位年龄66岁,52%为女性,28%/72%为ECOG PS 0/1,既往系统治疗的中位线数为1(范围0-4+)。根据BICR评价的改良RANO标准,IC ORR为31.6%[6/19;3例完全缓解(CR),2例部分缓解(PR),1例未确认(PR)];IC疾病控制率(DCR)为84.2%[16/19,包括10例疾病稳定(SDs)]。未达到中位IC DOR(95%CI 4.1–NE);中位IC PFS为4.2个月(95%CI 3.8–NE)。
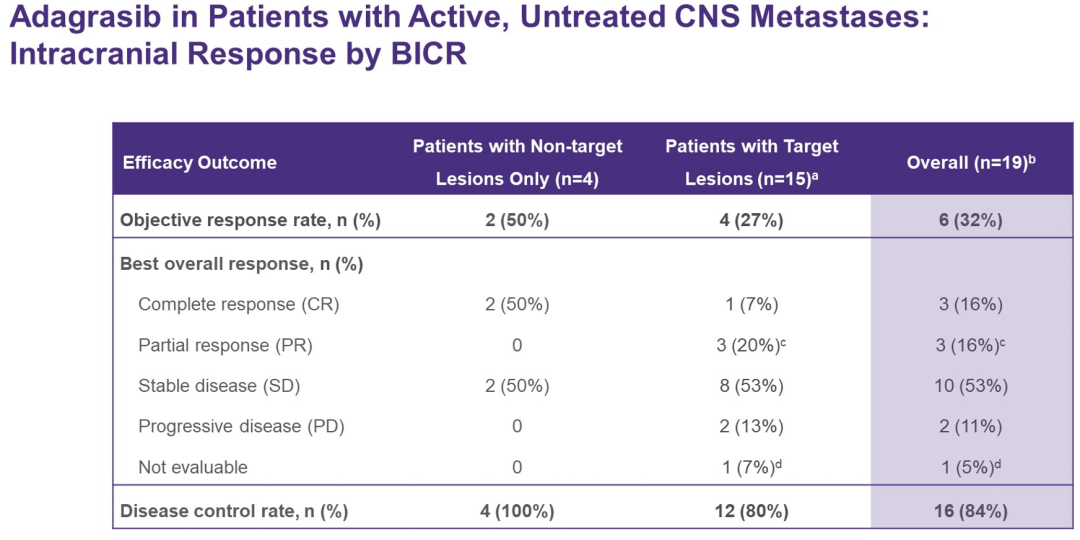
为两例观察到CNS转移灶退缩的患者采集了CSF样本,Ada的CSF浓度超过在其他治疗中观察到的CNS渗透分割系数,证明了CNS渗透性和CNS抗肿瘤活性(Kp,uu 0.47)。BICR评价的系统ORR为35.0%(7/20),DCR为80.0%(16/20),中位DOR为9.6个月(95%CI 2.7-9.6);中位PFS为5.6个月(95%CI 3.8-11.0)。
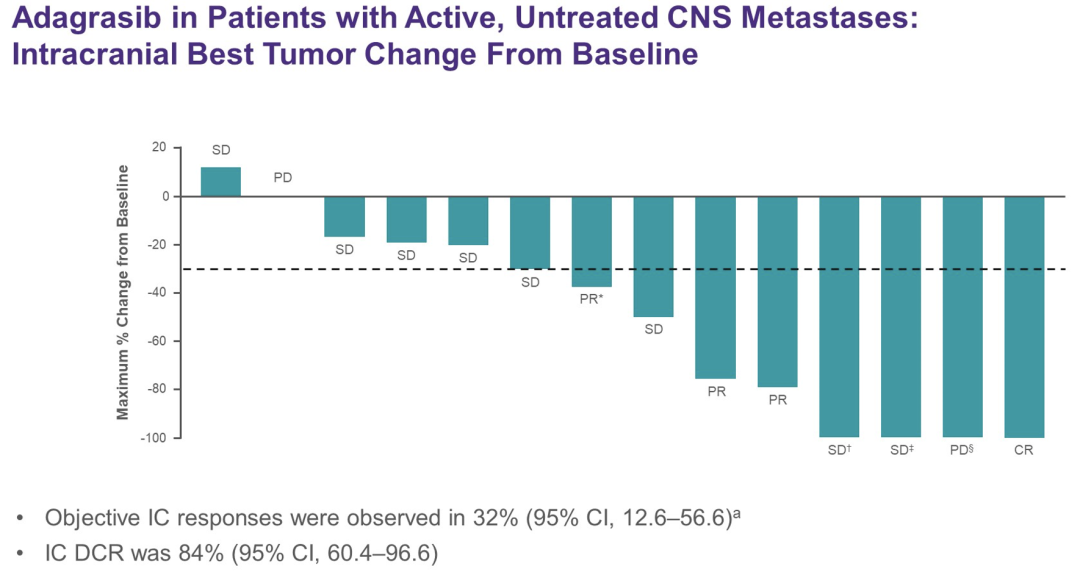
对所有入组的患者,OS数据尚不成熟,在分析时未达到中位数。安全性与之前报告的Ada情况一致;96%的患者出现任何级别的治疗相关性不良事件(TRAE),36%的患者出现3级TRAE,没有4/5级TRAE。以后将进一步展现描述IC活动的IC RECIST评估数据。
这些初步数据表明,在具有KRAS G12C突变和活动性未治的CNS mets的NSCLC经治患者中,Ada具有良好的耐受性、CNS渗透性和有效的IC活性,且该研究的临床数据首次证实,KRAS G12C抑制剂具有CNS特异性抗肿瘤活性。
LBA9023-Entrectinib在ROS1阳性(ROS1+)晚期/转移性NSCLC患者的疗效/安全性:血液首次检测筛选试验(BFAST)
基于组织的生物标志物检测仍然具有挑战性,因为肿瘤活检通常不足以进行全面的生物标志物检测,并且在晚期/转移性非小细胞肺癌(NSCLC)患者中重复活检可能有风险。这些挑战可能通过使用基于血液的检测来确定最合适的靶向治疗来克服。

BFAST(NCT03178552)是一项全球性的开放标签、多队列试验,旨在通过二代测序(NGS)评估游离细胞DNA(液体活检),确定携带驱动基因变异的晚期/转移性NSCLC患者中所选疗法的疗效和安全性。瑞士Lausanne大学医院Solange Peters研究团队展示了来自ROS1+队列的数据:这是首次前瞻性、在基于血液的NGS确定的患者中,对entrectinib的疗效进行评估。
在这项单臂分析中,初治可测量的IIIB/IV期NSCLC成年(≥18岁)患者,经FoundationOne Liquid® CDx CTA基于血液的NGS检测评估ROS1+,接受entrectinib 600mg/d 口服,直到疾病进展(PD)、不可接受的毒性、知情同意撤销或死亡。筛选时无症状脑转移的患者符合入组条件。
在基线时和之后每隔8周,对所有疾病累及区域进行肿瘤扫描(无基线中枢神经系统(CNS)病灶的患者不要求进行脑部影像检查)。主要终点为研究者(INV)评估的客观缓解率(ORR),通过实体瘤疗效评价标准(RECIST)1.1评估。次要终点包括INV评估的缓解持续时间(DoR)和无进展生存期(PFS);独立审查机构(IRF)评估ORR、DoR、PFS、总生存期(OS);至CNS疾病进展(PD)的时间,安全性。
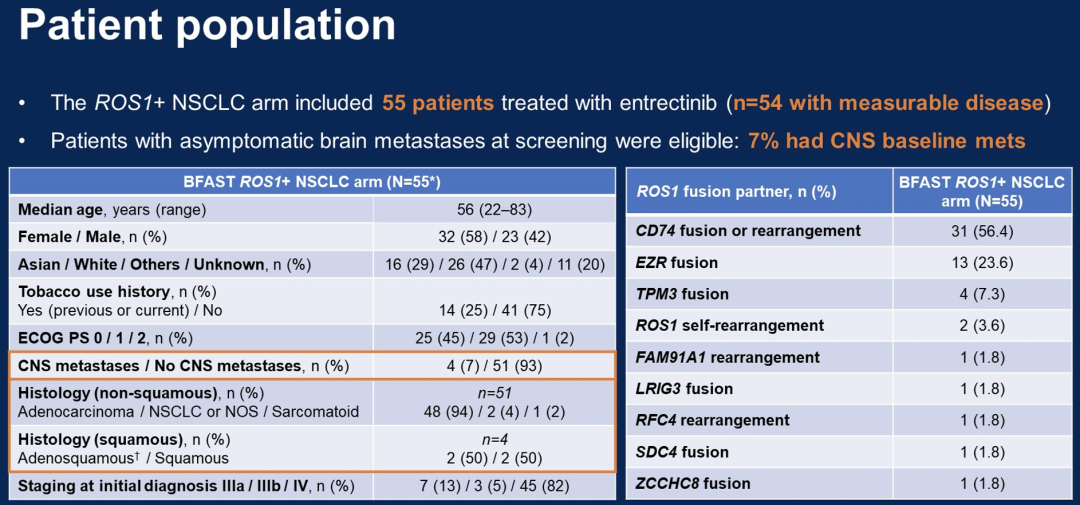
55例经基于血液的NGS确认的ROS1+ NSCLC患者被纳入研究,并接受entrectinib治疗。平均年龄为56岁;58%为女性,75%没有吸烟史。非鳞状腺癌是最常见的组织学类型(n = 48/55;87%);4例患者(7.3%)有基线CNS病灶。中位随访18.3个月。在数据截止时(2021年11月26日,n = 54例患者有可测量病灶),确认的ORR为81.5%(n = 44/54,95%CI 68.6–90.8),INV评估2例完全缓解(CR),42例部分缓解(PR),IRF评估3例CR,41例PR。
INV评估的中位DoR为13.0个月(95%CI 6.3-18.4),IRF为16.7个月(95%CI 5.6-24.0)。INV评估的中位PFS为12.9个月(95%CI 8.7-18.5),IRF为14.8个月(95%CI 7.2-24.0)。OS数据不成熟,记录了20个事件(36.4%)。未达到CNS PD的中位时间(INV: 9个事件;IRF: 6个)。大多数治疗相关的不良事件不严重,无治疗相关死亡。

这些数据支持了基于血液的NGS作为ROS1+ NSCLC临床决策的另一种方法的临床价值。接受entrectinib治疗的ROS1+ NSCLC(基于血液的NGS)患者表现出持久的缓解,这与使用基于组织检测的entrectinib试验的结果一致。没有观察到新的安全性信号。
LBA9025-转移性非小细胞肺癌(NSCLC)一线治疗中,纳武利尤单抗(NIVO)联合伊匹木单抗(IPI)对比化疗(chemo)的5年生存结果:CheckMate 227的结果
在CheckMate 227第1部分(NCT02477826)研究中,无论肿瘤程序性死亡配体1(PD-L1)表达水平如何,NIVO+IPI在转移性NSCLC患者(pts)中的一线治疗中均表现出长期持久的生存获益。在此,我们展示在转移性NSCLC一线治疗中,免疫联合治疗3期临床试验的最长已报道的随访时间(5年)。
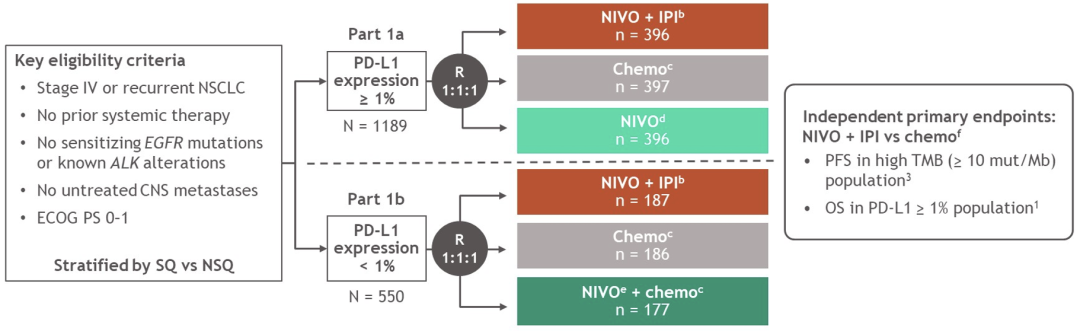
研究纳入初治的IV期或复发性、无已知EGFR/ALK基因突变、ECOG表现状态 ≤ 1的成人NSCLC患者,以组织学分层。PD-L1≥ 1%的患者以1:1:1随机分配至NIVO(3 mg/kg Q2W)+IPI(1 mg/kg Q6W),NIVO(240 mg Q2W)或chemo。PD-L1<1%的患者以1:1:1随机分配至NIVO+IPI,NIVO(360mg Q3W)+chemo或chemo。患者接受治疗直至疾病进展、不可耐受的毒性,免疫治疗时间不超过 2年。
评估终点包括总生存期(OS),无进展生存期(PFS),客观缓解率(ORR),缓解持续时间(DOR)和新的疗效终点:无治疗间隔。在停止研究治疗(出于任何原因,包括治疗完成)的患者中测量无治疗间隔,其定义为:从最后一剂研究性治疗到开始后续系统性治疗或死亡的时间,以先发生者为准。
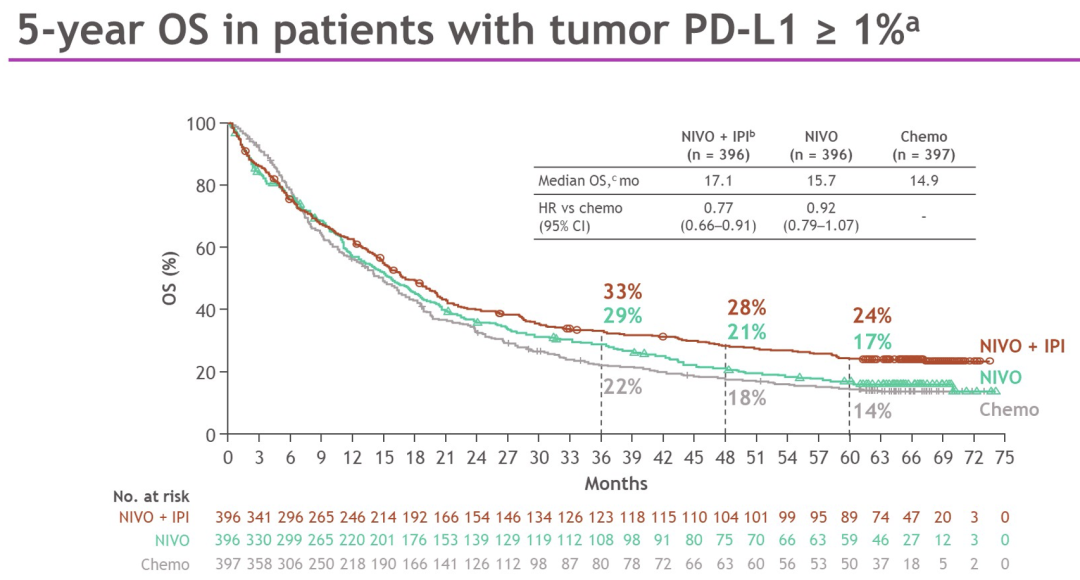
最小随访时间为61.3个月(数据库锁定,2022年2月15日)。在PD-L1≥ 1%的患者中(N=1189),与chemo相比,NIVO+IPI组OS持续长期获益(HR,0.77[95%CI,0.66-0.91]);5年OS率分别为24%(NIVO+IPI),17%(NIVO)和14%(chemo)。
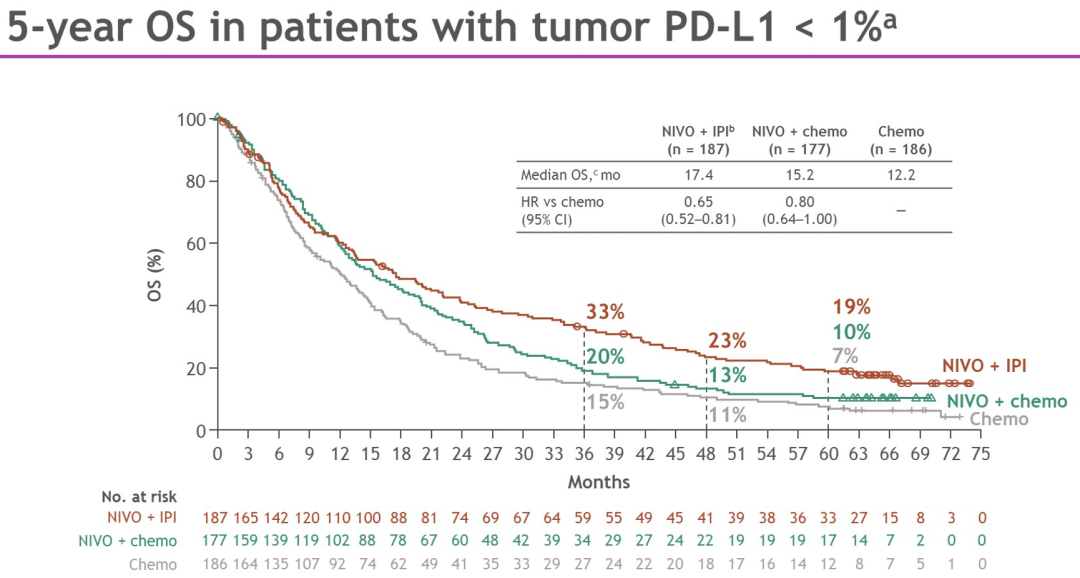
PD-L1<1%(N=550)的患者中,与chemo相比,NIVO+IPI组OS也持续获益(HR,0.65[95%CI,0.52-0.81]);5年OS率分别为19%(NIVO+IPI),10%(NIVO+chemo)和7%(chemo)。
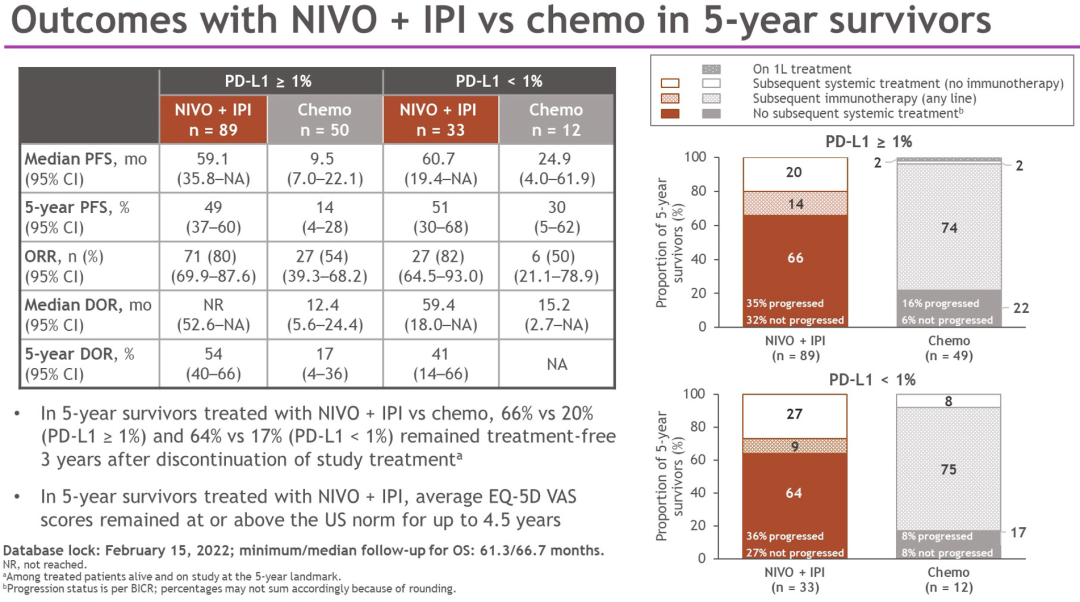
以其他的研究终点评价,在总人群中和5年仍存活的患者中, NIVO+IPI对比 chemo均观察到临床获益。NIVO组和NIVO+chemo组PFS,ORR和DOR数据有待进一步展示。在NIVO+IPI组且5年仍存活的患者中,66%(PD-L1≥ 1%)和64%(PD-L1<1%)患者在治疗结束后,维持超过3年无治疗间期;PD-L1≥ 1%和PD-L1<1%的患者中,NIVO±IPI治疗的中位持续时间分别为17.7个月(范围)(0-25.5)和9.5个月(0-25.1)。没有观察到新的安全信号。
通过最少5年的随访,研究发现,不管患者PD-L1表达水平如何,NIVO+IPI与化疗相比在初治转移性NSCLC患者中继续提供长期,持久的临床获益。NIVO+IPI增加了5年生存率;大多数患者在停止治疗后,维持超过3年的无治疗期。
LBA9026-一线(1L)纳武利尤单抗(NIVO)+伊匹木单抗(IPI)+2周期化疗(chemo)对比单纯化疗(4周期)治疗转移性非小细胞肺癌(NSCLC)患者:来自CheckMate 9LA的3年更新
在CheckMate 9LA(NCT03215706)研究中,一线(1L)纳武利尤单抗(NIVO)+伊匹木单抗(IPI)联合2个周期的化疗,被证明在转移性非小细胞肺癌(NSCLC)患者中相比单独化疗有更多生存获益。西班牙12 de Octubre大学医院Luis G. Paz-Ares研究团队报告了该研究至少3年随访的最新疗效和安全性,以及研究的探索性生物标志物分析。
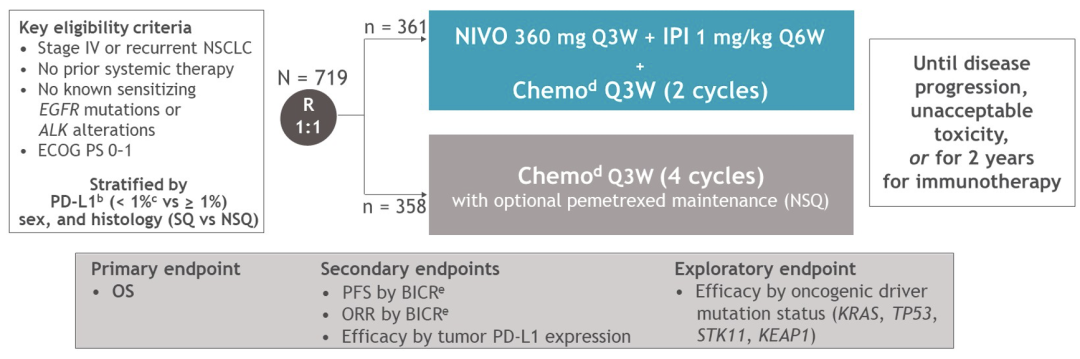
IV期或复发性NSCLC,没有已知的EGFR/ALK敏感突变,ECOG体力状态≤1的成年患者被随机1:1分配到NIVO 360 mg Q3W + IPI 1 mg/kg Q6W + 2个周期的化疗(n = 361)或4个周期的单纯化疗(n = 358)。根据肿瘤程序性死亡配体1(PD-L1)表达、性别和组织学类型对患者进行分层。单纯化疗组中的非鳞状(NSQ)NSCLC患者可以接受培美曲塞维持治疗。
研究者对总生存期(OS)、无进展生存期(PFS)和客观缓解率(ORR)进行评估。对于所有患有NSQ NSCLC且组织可进行突变分析评估的患者(n = 313),用FoundationOne CDxTM检测鉴定突变型(mut)或野生型(wt)KRAS和STK11基因。探索性评估包括通过突变状态和安全性评估的NIVO + IPI +化疗与单纯化疗的OS和PFS。
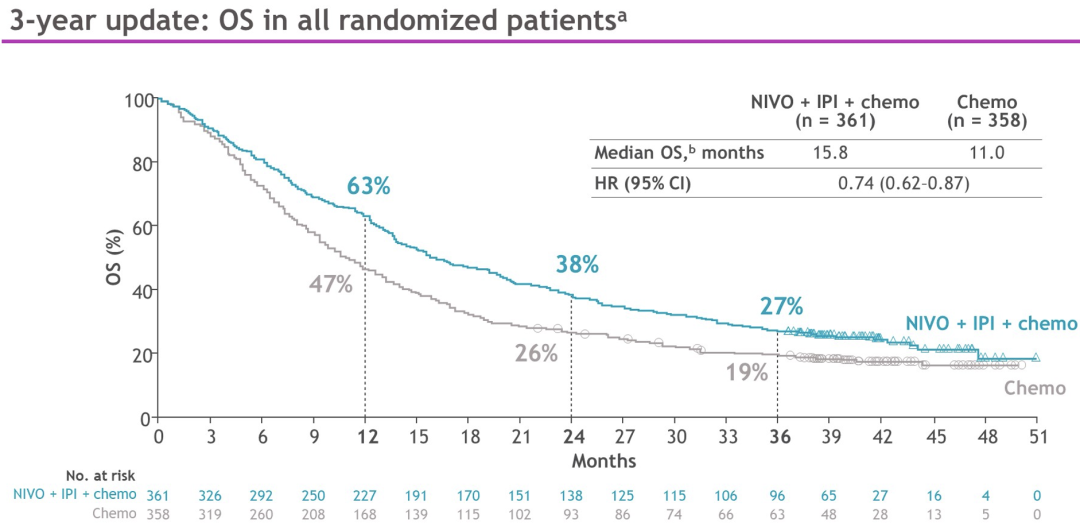
在至少36.1个月的随访中(截至2022年2月15日),NIVO + IPI +化疗与单纯化疗相比,患者继续获得长期、持久的OS获益[风险比(HR)0.74(95%CI,0.62-0.87)];3年OS率分别为27%和19%。在所有随机患者和大多数亚组中观察到NIVO + IPI +化疗与单纯化疗相比的临床获益,包括PD-L1表达水平(见下表)或组织学类型。
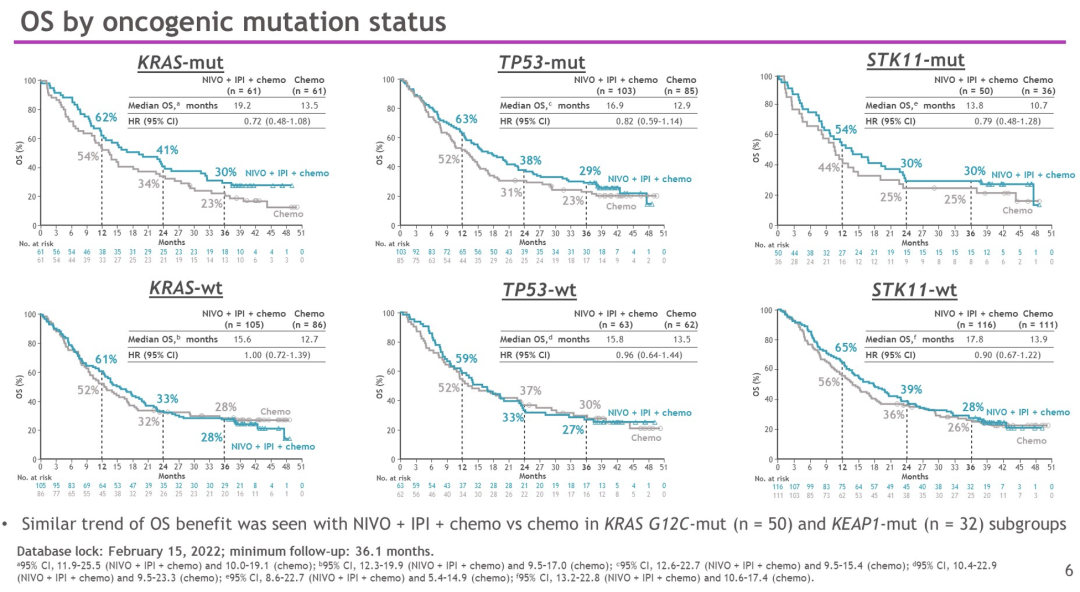
在对可评估的KRAS和STK11突变的患者的探索性分析中,NIVO + IPI +化疗与单纯化疗相比,OS似乎有所改善(中位OS,16.3 vs 13.1个月)。在是否有KRAS突变(中位OS,mut:19.2 vs 13.5个月;wt: 15.6 vs 12.7个月)或STK 11突变(mut:13.8 vs 10.7个月;wt:17.8 vs 13.9个月)的患者中,也观察到NIVO + IPI +化疗对比单纯化疗,具有延长OS的相似趋势。将来会继续展示其他疗效结果。延长随访未发现新的安全性信号。
通过至少3年的随访,1L NIVO + IPI +化疗在转移性NSCLC患者中显示出长期、持久的疗效优势。不管KRAS和STK11突变状态如何,观察到NIVO + IPI +化疗相对于单纯化疗的生存获益。
LBA9500-在IIB或IIC期黑色素瘤辅助治疗中,帕博利珠单抗和安慰剂的无远处转移生存率对比:III期KEYNOTE-716研究。
在之前对III期双盲KEYNOTE-716研究的分析中,帕博利珠单抗辅助治疗(pembro)与安慰剂相比,在已切除 IIB 或 IIC期(AJCC-8)黑色素瘤患者中显著提高了无复发生存率。来自悉尼大学的研究人员报告了KEYNOTE-716研究中无远处转移生存率(DMFS)和延长随访的无复发生存率(RFS)结果。
研究共纳入976例年龄≥12岁,IIB或IIC期皮肤黑色素瘤完全切除,且前哨淋巴结活检阴性的患者。研究第一部分(Part 1),患者以1:1的比例随机分为pembro 200 mg(儿科患者为2 mg/kg)和安慰剂组,接受17个周期的治疗(Q3W,约为期1年)。成年患者的随机分组按T类别3b,4a,4b进行划分,儿科患者单独划分。治疗持续到疾病复发或出现不可接受的药物毒性。在Part 1中接受安慰剂治疗,或在完成Part 1后6个月内未出现疾病进展的患者,有资格在复发时接受额外的pembro Q3W治疗(Part 2)。研究主要终点为RFS,次要终点为DMFS。本次中位随访的数据截止日期为2022年1月4日。
在26.9个月(4.6-39.2个月)的中位随访中,与安慰剂相比,pembro辅助治疗显著改善了患者DMFS(HR 0.64,95% CI,0.47-0.88;P=0.0029;两组均未达到中位值(NR)),24个月DMFS为88.1%(pembro)和82.2%(安慰剂)。延长随访显示,pembro辅助治疗保持了低于安慰剂的复发风险(HR 0.64,95% CI,0.50-0.84),24个月RFS为81.2%(pembro)和72.8%(安慰剂)。
Pembro组有137例患者(28.4%)发生3级以上任何原因不良事件(AE),安慰剂组有97例(20.0%)。Pembro组有83例患者(17.2%)发生≥3级药物相关AE,安慰剂组有24例(4.9%)。Pembro组有1例患者因任何原因AE死亡,安慰剂组有5例,研究中未发生药物相关死亡。Pembro组有182例患者(37.7%)发生免疫介导AE,安慰剂组有45例(9.3%),其中最常见的为甲状腺功能减退(17.2%和3.7%)。
这个研究表明,在切除后的IIB和IIC期皮肤黑色素瘤辅助治疗中,帕博利珠单抗与安慰剂相比显著改善了DMFS,并在延长随访中保持了优于安慰剂的PFS,是有利的辅助治疗方案。
LBA9509-肝脏隔离灌注作为治疗葡萄膜黑色素瘤肝转移的方法,III期随机对照多中心临床研究(SCANDIUM研究)初结果
葡萄膜黑色素瘤是成人最常见的原发性眼内恶性肿瘤。即便成功控制原发病灶,大约50 %的患者会出现转移,其中肝转移最为常见。肝转移患者的中位生存期约为6-12个月,并极少有能延长生存期的系统治疗方案。之前一项采用肝脏隔离灌注(IHP)的研究发现,接受IHP的患者与瑞典同期生存最长的历史对照组相比,总体生存期增加了14个月(26个月 vs 12个月)。
在这项多中心,随机,对照,III期试验中,未治疗的葡萄膜黑色素瘤孤立性肝转移患者,在2013年至2021年间随机分组接受IHP或最佳替代治疗(对照组)。研究主要终点为24个月的总生存率,来自瑞典哥德堡大学的研究人员报告了根据RECIST 1.1评价的次要研究终点,分别为无进展生存期(PFS),肝脏PFS(hPFS)和治疗毒性。
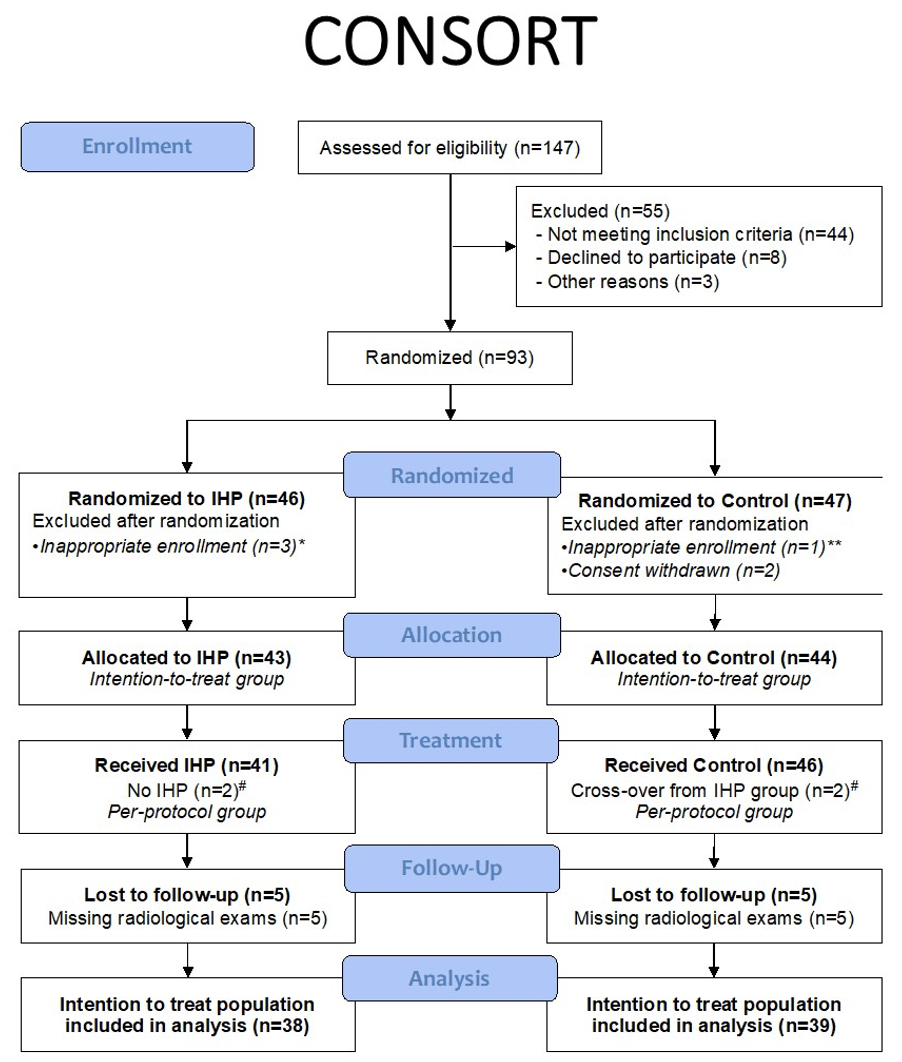
研究纳入93例患者随机分组,每组有3名患者因撤回同意书或不适合入组而被排除,最后87例患者被分到IHP组(43例)和对照组(44例)。IHP组中,41例(89%)患者接受了治疗。对照组中,49%的患者接受了化疗,39%的患者接受了免疫治疗,9%的患者接受了局部治疗。
在意向治疗分析中,IHP组的总体缓解率(ORR)为40%(17/43),对照组为4.5%(2/44)(p<0.0001)。IHP组的中位hPFS为9.1个月(95% CI,5.6至13.4个月),对照组为3.3个月(95% CI,2.9至4.0个月)(p<0.0001)。IHP组的中位PFS为7.4个月(95% CI,5.2至11.6个月),对照组为3.3个月(95% CI,2.9至3.7个月)(p<0.0001)。
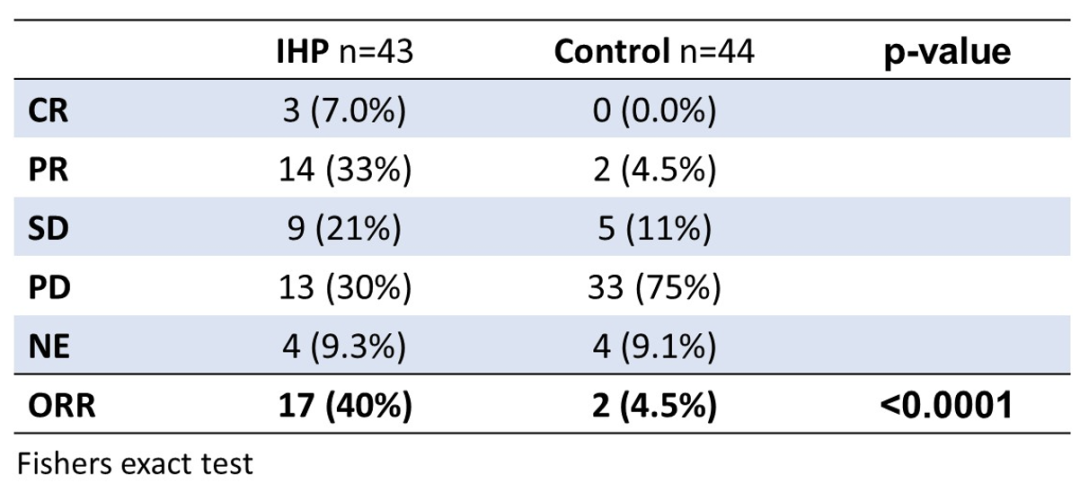
IHP组有14起与治疗相关的严重不良事件,其中最常见的为血管并发症和感染。对照组中有13起不良事件,最常见的为免疫治疗相关副作用。IHP组有1例与治疗相关的死亡。
以上数据表明,在未治疗的孤立性葡萄膜黑色素瘤肝转移患者中,与最佳替代治疗相比,IHP治疗提高了ORR,hPFS和PFS。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


