Molecular Therapy:海军军医大学李文林团队揭示ROCK抑制剂增强肝细胞移植的机制
来源:生物世界 2023-04-17 10:51
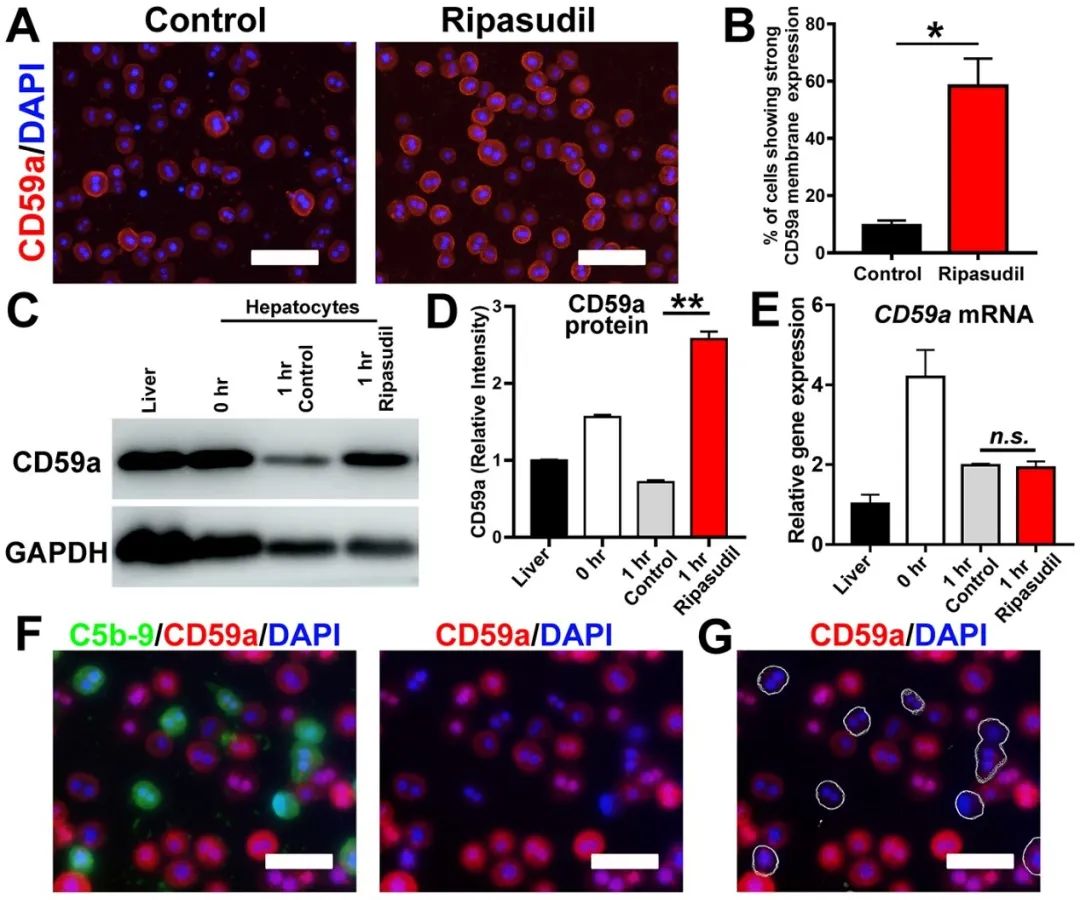
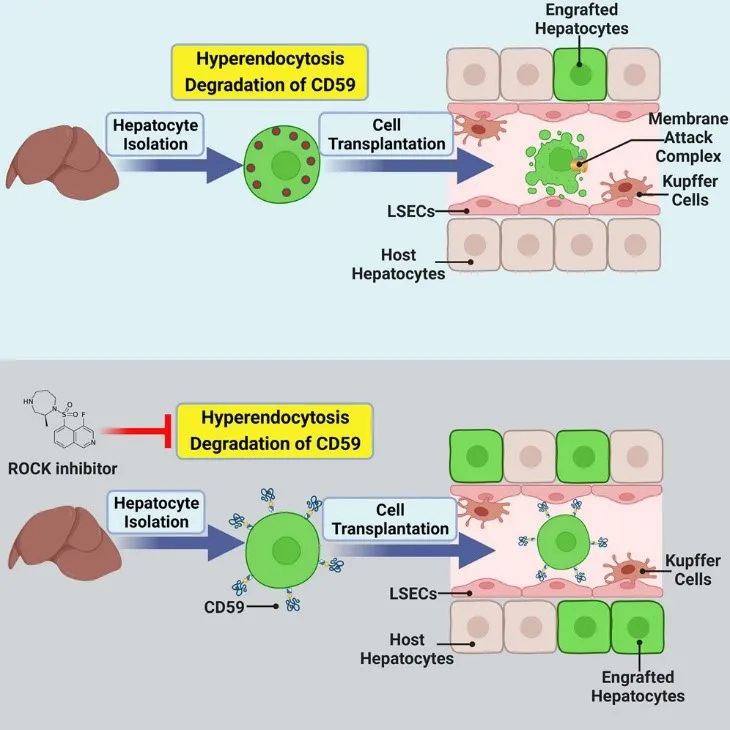
该研究发现肝细胞分离导致细胞膜补体抑制分子的降解是诱导肝细胞移植后被机体快速清除的主要原因;发现抑制ROCK可维持肝细胞膜蛋白的完整性、阻断膜攻击复合体的组装、并显著提高肝细胞移植后的定植效率(图3)
肝细胞移植作为原位肝移植的一种潜在的替代疗法,对于终末期肝病的治疗具有重要的研究意义,其优点包括:手术创伤小、操作简单、可进行多次移植等。然而,仍有一些障碍阻碍了肝细胞移植的临床应用。例如,大多数临床研究中使用的肝细胞通常来源于不适合器官移植的肝脏,肝细胞的来源和质量严重限制了肝细胞移植的应用。
近年来,由多能干细胞分化或者通过谱系重编程来得到的肝细胞或肝祖细胞的研究取得了显著的进步,有望最终解决此问题。肝细胞移植的另一个主要限制是肝细胞的体内植入效率极低。在肝细胞移植后的24小时内超过70%的肝细胞因血液介导的即刻炎症反应(Instant blood-mediated inflammatory reaction,IBMIR)而被清除;存活的肝细胞还必须穿过肝窦内皮细胞屏障迁移至肝板,并与宿主肝细胞建立细胞连接后才能成功植入宿主肝脏,最终只有大约2%-6%的肝细胞可以成功定植到宿主肝脏。
因此,提高肝细胞移植后在肝脏中的定植效率,是肝细胞移植应用于临床的迫切需要解决的问题。
近日,海军军医大学李文林团队在 Molecular Therapy 期刊发表了题为:ROCK inhibition enhanced hepatocyte liver engraftment by retaining membrane CD59 and attenuating complement activation 的研究论文。
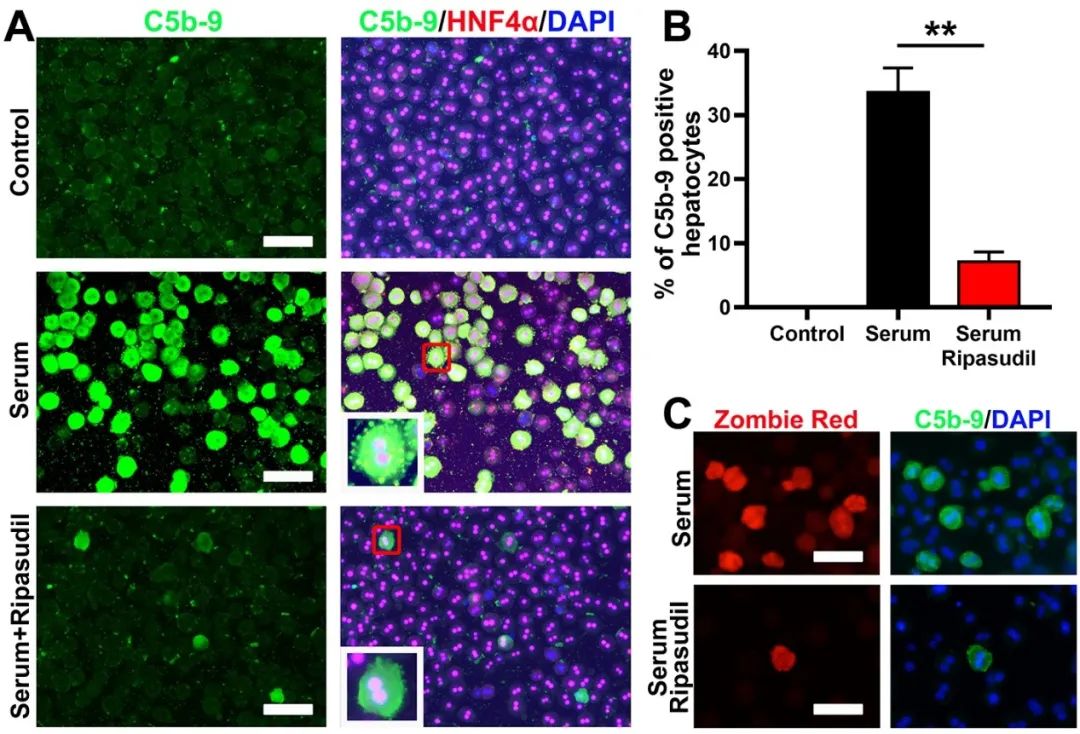
该研究表明,肝细胞的分离导致细胞膜蛋白(包括补体抑制分子CD59)的大量降解,ROCK(Rho-associated coiled-coil containing kinases)抑制剂可以通过保留细胞膜CD59和阻断膜攻击复合物(membrane attack complex,MAC)的形成来保护移植的肝细胞、提高肝细胞的定植效率。
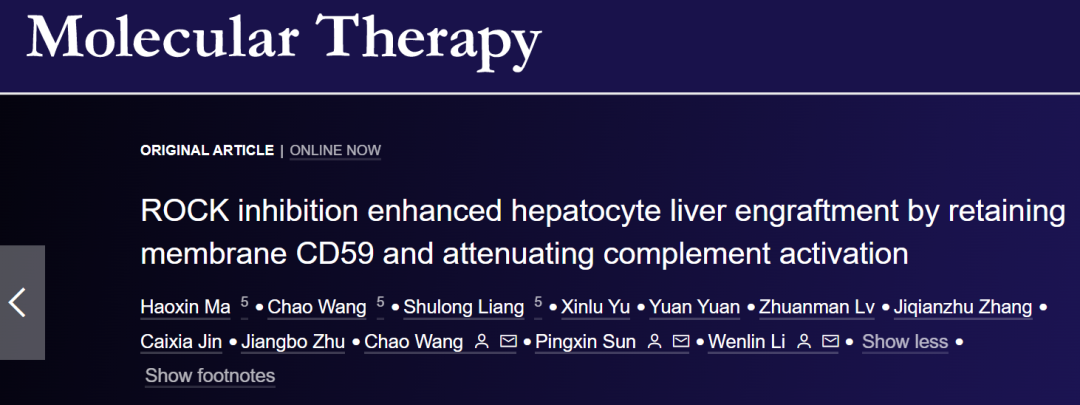
在这项研究中,研究团队通过筛选发现ROCK抑制剂可显著增强肝细胞移植后在肝脏中的定植。体外补体活化实验表明ROCK抑制剂可以阻断膜攻击复合体(C5b-9)在肝细胞表面的组装(图1)。体内实验进一步证实了抑制ROCK可保护移植的肝细胞免受宿主补体系统的攻击。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


