股价下跌超60%,间充质干细胞疗法上市被拒,FDA要求补充试验数据
来源:生辉 2023-08-08 15:35
移植物抗宿主病(GvHD)是由于移植物的抗宿主反应而引起的一种免疫性疾病,是同种异体造血干细胞移植的主要并发症和造成死亡的主要原因。
移植物抗宿主病(GvHD)是由于移植物的抗宿主反应而引起的一种免疫性疾病,是同种异体造血干细胞移植的主要并发症和造成死亡的主要原因。
GvHD 分为 2 种形式,即急性和慢性,可影响多种器官系统,最常见的受累器官为皮肤、消化道和肝脏。临床上,大多数患者采用糖皮质激素治疗,这是一类类固醇药物,长期使用会导致严重的健康并发症。发生类固醇难治急性 GvHD 的患者可发展为严重的疾病,一年死亡率约为 70%。据估计,每年约有一半的急性 GvHD 患者对类固醇治疗应答不足。
澳大利亚生物技术公司 Mesoblast(NASDAQ: MESO)就在开发治疗类固醇难治性急性移植物抗宿主病(SR-aGvHD)儿童的间充质干细胞疗法 remestemcel-L。
但 FDA 于近日再次拒绝了批准该疗法的上市申请。受此消息影响,公司股价在盘前交易中下跌超 60%。
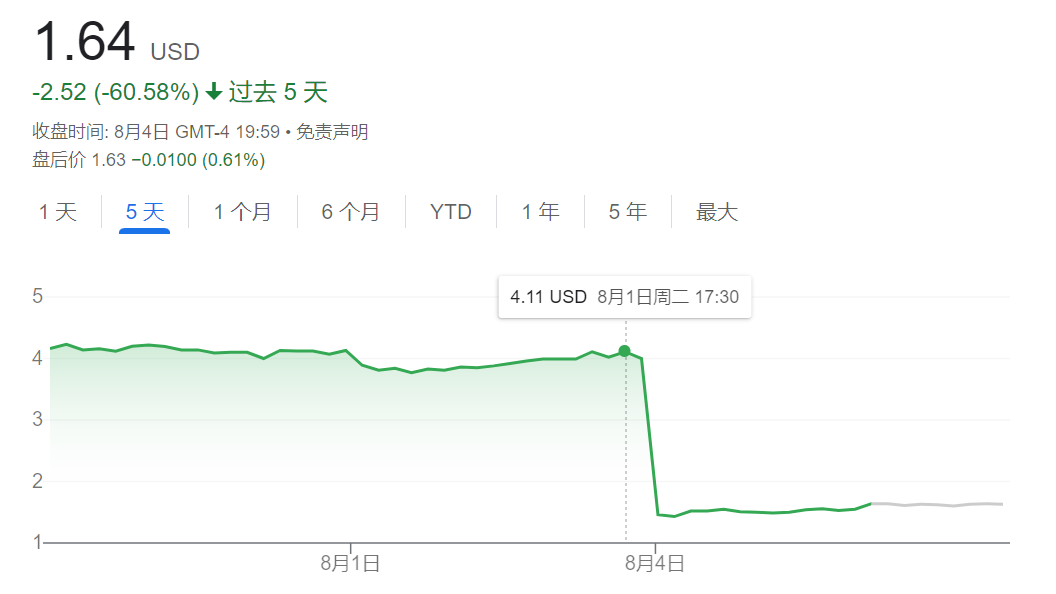
(来源:Google)
首席执行官 Silviu Itescu 在新闻稿中指出,FDA 对该生物技术生产过程的检查“没有发现任何问题”,监管机构也没有对在各种试验中接受 remestemcel-L 的 1300 多名患者提出任何安全问题。
在完整回应函(CRL)中,监管机构要求在重新考虑申请之前提供更多成年患者的数据。为了满足这一要求,Mesoblast 计划对死亡率最高的高危成年人进行一项对照研究,成人患者占类固醇难治性急性患者的 80%。迄今为止,现有的治疗方法未能显著改善死亡风险最高的成年患者的预后,90 天生存率停滞在 20%-30% 之间。
Mesoblast 于 2019 年 5 月首次尝试获得批准,其提供的临床数据显示治疗反应率和患者存活率很高。Mesoblast 还在 2020 年 8 月赢得了 FDA 肿瘤药物咨询委员会的大力支持,当时该小组以 9 比 1 的投票赞成批准;然而,FDA 于 2020 年 10 月拒绝了该药物。
同期,JAK 抑制剂芦可替尼成功在美国获批用于治疗 12 岁以上类固醇难治 aGVHD 患者,进一步为 remestemcel-L 的上市增加了阻碍。
2023 年 3 月,FDA 接受了 Mesoblast 重新提交的文件,其中包括至少四年的长期生存结果以及高风险患者的结果数据。在重新提交之前,监管机构还完成了对 Mesoblast 生产设施的许可前检查,没有发现任何问题。
Mesoblast 计划在未来 45 天内与 FDA 举行 A 类会议,以敲定试验细节。Silviu Itescu 透露试验将覆盖多达 40 个美国站点。鉴于参与者对治疗没有反应并且病得很重,因此不会有安慰剂组。
Remestemcel-L 是一种人骨髓来源的间充质干细胞产品。它已在日本、加拿大和新西兰被批准用于儿科治疗类固醇难治性急性移植物抗宿主病。

▲图 | Mesoblast 管线(来源:公司官网)
Mesoblast 成立于 2004 年,源自阿德莱德和汉森医学研究所十多年来开发的技术。其先后收购了 Silviu Itescu 创立的 Angioblast Systems Inc,以及美国制药集团 Osiris Therapeutics 的知识产权。前者专门从事心脏干细胞治疗;GvHD 项目则衍生于后者收购的平台。
此外,Mesoblast 还在研究用于心力衰竭以及椎间盘退变引起的慢性腰痛等的药物。
心脏项目进展不太顺利。2016 年,合作伙伴 Teva 放弃了一项为心脏项目提供资金的交易;2018 年,一项由 159 名患者参与的研究人员主导的治疗慢性心力衰竭的 III 期试验未能达到使患者暂时脱离左心室辅助装置的主要终点;在 2020 年一项针对 537 名患者的心脏试验中,也未能达到减少慢性心力衰竭患者心力衰竭事件的主要终点;Mesoblast 现在计划针对 II-III 级和濒临死亡的晚期患者启动两项后续 III 期试验。
截至 3 月底,Mesoblast 仅有 4880 万美元可用现金储备,另有 4000 万美元通过私募股票筹集。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


