研究揭示内质网P5A ATPase/CATP-8通过清除异位蛋白维持内质网“身份”
来源:生物物理所 2020-11-17 12:50
膜蛋白被正确地定位到相应的细胞器上对于维持细胞器特异“身份”和生理功能较为重要。膜蛋白的正确定位依赖于精确的蛋白分选通路,并需要细胞器上相应的机制清除错误定位的蛋白。如在线粒体外膜的AAA-ATPase Msp1可以把错误定位到线粒体外膜的蛋白清除。然而,在内质网(ER)上是何种机制帮助移除错误定位的膜蛋白尚需探索。11月10日,中国科学院生物物
膜蛋白被正确地定位到相应的细胞器上对于维持细胞器特异“身份”和生理功能较为重要。膜蛋白的正确定位依赖于精确的蛋白分选通路,并需要细胞器上相应的机制清除错误定位的蛋白。如在线粒体外膜的AAA-ATPase Msp1可以把错误定位到线粒体外膜的蛋白清除。然而,在内质网(ER)上是何种机制帮助移除错误定位的膜蛋白尚需探索。
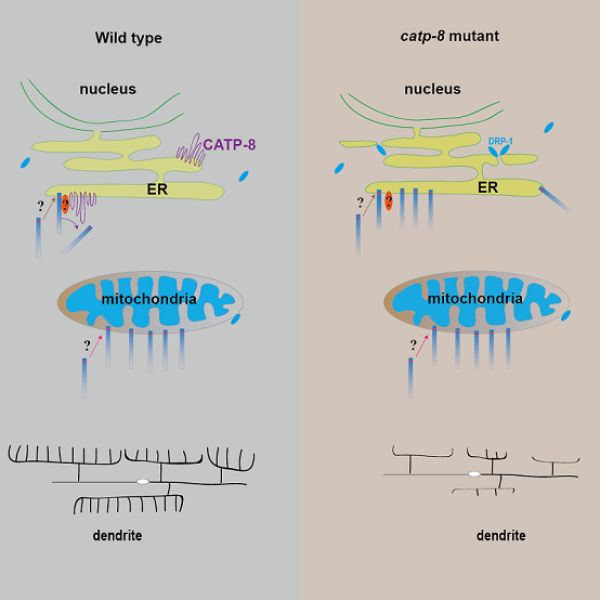
11月10日,中国科学院生物物理研究所博士王香明和美国斯坦福大学教授沈康合作,在Cell Reports上发表题为An Endoplasmic Reticulum ATPase Safeguards Endoplasmic Reticulum Identity by Removing Ectopically Localized Mitochondrial Proteins的研究论文。该研究发现P5A ATPase/CATP-8可以将错误定位到ER上的线粒体信号锚定蛋白(signal anchored,SA)和尾部锚定蛋白(tail anchored,TA)移除,维持ER特异“身份”。
研究人员以线粒体SA/TA蛋白为研究对象,在线虫中进行大规模筛选,发现catp-8突变体导致线粒体SA/TA蛋白错误定位至ER,而线粒体表面的两次跨膜蛋白不会被影响。荧光定位实验发现CATP-8特异定位在ER上,暗示其在ER上发挥功能。同时,通过光转换和热激诱导表达实验,该研究发现CATP-8可以将已经错误定位到ER上的线粒体蛋白移除,并且该过程不依赖于ERAD通路。为了研究CATP-8移除ER错误定位蛋白对维持ER特异“身份”的重要性,研究人员发现线粒体外膜蛋白FIS-1和MFF-2在catp-8突变体中错误定位至ER,导致线粒体分裂因子DRP-1被错误招募到ER上,从而引起ER断裂。此外,研究团队发现CATP-8通过调控树突受体蛋白DMA-1水平影响线虫PVD神经元树突形态发育,暗示CATP-8不仅通过移除错误定位到ER的线粒体蛋白以维持正确的ER形态,还对维持ER正常生理功能起重要作用。该研究报道ER蛋白P5A ATPase/CATP-8行使监察机制将错误定位在ER上的蛋白移除,以及其对维持ER正确的形态和功能的重要性。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


