Cell Genomics:AI 助力抗癌新突破!机器学习模型精准预测肿瘤侵袭性
来源:生物谷原创 2025-07-30 09:39
PROTsi 在多个数据集中均表现出了稳定且一致的性能。它能够清晰地区分干细胞和分化细胞,不同类型的肿瘤在干性指数上呈现出不同的中间水平。
肿瘤,作为全球范围内导致死亡的主要原因之一,其威胁正日益加剧,尤其是对年轻人群体的冲击愈发显著。一项于 2023 年发表在《BMJ Oncology》杂志上的重磅研究指出,在 1990 年至 2019 年期间,50 岁以下成年人的早期癌症发病率飙升了 79%,癌症相关死亡率也攀升了 28%。该研究涵盖了 204 个国家,对 29 种癌症类型进行了深入剖析。
巴西国家癌症研究所(INCA)预测,在 2023 年至 2025 年期间,每年新增癌症病例将高达 70.4 万例。依据《2023 年巴西癌症发病率估计报告》,最常见的恶性肿瘤依次为非黑色素瘤皮肤癌(占总病例的 31%)、女性乳腺癌(10.5%)、前列腺癌(10%)、结直肠癌(6.5%)、肺癌(4.6%)以及胃癌(3%) 。
随着全球癌症病例数持续攀升,癌症本身的复杂性也在同步增加,这无疑给癌症的诊断与治疗带来了前所未有的挑战,亟待科学界寻求新的突破。在此严峻形势下,人工智能(AI)技术异军突起,逐渐成为癌症预测与检测领域的有力武器。
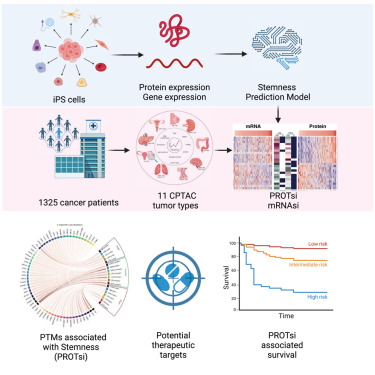
近期,来自巴西、波兰、美国、加拿大和意大利的国际科研团队取得了一项关键进展。他们成功开发出一种创新的机器学习模型,该模型能够通过识别特定蛋白质,精准预测某些肿瘤的侵袭性。具体而言,它会生成一个介于 0 到 1 之间的干性指数(stemness index),数值为 0 代表肿瘤侵袭性低,而数值为 1 则意味着肿瘤具有高侵袭性。研究表明,随着干性指数的升高,癌症往往会变得更具侵袭性,对药物的耐药性增强,复发的可能性也显著提高。相关研究成果已发表于《Cell Genomics》杂志。

干性程度反映的是肿瘤细胞与多能性干细胞的相似程度,多能性干细胞具备转化为人体内几乎任何类型细胞的能力。在疾病发展过程中,恶性细胞会逐渐与原发组织的特征偏离,这些细胞不仅拥有自我更新能力,还呈现出未分化的表型特征。
为构建这一强大的机器学习工具,研究人员充分利用了临床蛋白质组学肿瘤分析联盟(CPTAC)提供的 11 种癌症数据集,并在此基础上建立了基于蛋白质表达的干性指数(PROTsi)。他们对超过 1300 份涵盖乳腺癌、卵巢癌、肺癌(鳞状细胞癌和腺癌)、肾癌、子宫癌、脑癌(儿童和成人)、头颈癌、结肠癌和胰腺癌等多种癌症类型的样本进行了详细分析。
通过巧妙地将 PROTsi 与 207 份多能性干细胞的蛋白质组学数据整合,研究人员成功识别出了驱动某些肿瘤侵袭性的关键蛋白质。这些蛋白质分子有望成为开发全新通用或针对性治疗手段的潜在靶点,为癌症治疗开辟新的路径。因此,该工具不仅能够有力推动癌症治疗药物的临床研发进程,还能助力实现癌症治疗的个性化定制,让每一位患者都能获得更精准、更有效的治疗方案。
论文的共同通讯作者、巴西圣保罗大学里贝朗普雷图医学院多组学与分子肿瘤学实验室的 Tathiane Malta 教授指出:“在我们识别出的蛋白质中,有许多已经是市场上用于治疗癌症患者及其他疾病的药物作用靶点,后续研究可以基于我们的发现进一步开展深入测试。我们通过深入研究干性表型与肿瘤侵袭性之间的关联,得出了这些重要结论。”
早在 2018 年,Malta 教授作为论文第一作者在《Cell》杂志发表过相关文章(Cell, 2018, doi:10.1016/j.cell.2018.03.034) ,当时她的团队开发出一种干性指数,能够客观地衡量肿瘤样本与多能性干细胞之间的相似性。Malta 教授补充道:“那时,我们借助美国癌症基因组图谱(Cancer Genome Atlas)维护的公开肿瘤数据库,开发了基于机器学习的算法,主要依赖基因表达数据、RNA 定量数据以及包括 DNA 甲基化在内的表观遗传学数据。如今,我们与基于蛋白质组学的 CPTAC 数据库展开合作,通过对蛋白质 —— 这一具有治疗应用潜力和临床价值的功能分子的分析,对我们的研究进行了更新与升级。”
从目前取得的研究结果来看,PROTsi 与先前发表的基于转录组学衍生的干性评分呈现正相关关系。而且,PROTsi 在区分肿瘤样本和非肿瘤样本方面展现出了更高的效能。Malta 教授的导师 Renan Santos Simões 表示,在表征干性以及深入研究蛋白质水平及其修饰方面取得的进展,为我们深入理解肿瘤进展机制以及当前癌症疗法的耐药机制奠定了坚实基础。
Simões 教授说道:“科学的进步是一个缓慢而严谨的过程,需要众多科研人员的共同努力。能够意识到我们正在为这一进程贡献力量,令人深感欣慰。激励我们不断前行的动力,正是源于我们深知今天所做的工作,未来能够切实改变患者的命运,提升他们的治疗效果和生活质量。”
在后续的验证过程中,PROTsi 在多个数据集中均表现出了稳定且一致的性能。它能够清晰地区分干细胞和分化细胞,不同类型的肿瘤在干性指数上呈现出不同的中间水平。例如,在子宫癌和头颈部癌病例中,PROTsi 成功展现出了出色的预测能力。此外,该工具在区分腺癌、子宫癌、胰腺癌和儿童脑癌样本中的高分化肿瘤方面,也表现得尤为有效。Malta 教授表示:“我们致力于构建一种能够广泛应用于各类癌症的模型,尽管发现它对某些癌症的适用性更为突出,但这也为未来的研究提供了极具价值的数据参考。”(生物谷Bioon.com)
参考文献:
Iga Kołodziejczak-Guglas et al, Proteomic-based stemness score measures oncogenic dedifferentiation and enables the identification of druggable targets, Cell Genomics (2025). DOI: 10.1016/j.xgen.2025.100851.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


