《自然》:要命的脑瘤是“闻出来”的?浙大科学家首次证实,嗅觉可以激活功能神经环路,直接调控脑胶质瘤的发生
来源: 奇点糕 2022-05-14 17:35
嗅觉是生命体最古老原始的感官,但人类对嗅觉的认识直到1991年才有突破性进展。
嗅觉是生命体最古老原始的感官,但人类对嗅觉的认识直到1991年才有突破性进展。
那一年,美国科学家Richard Axel和他的博后Linda B. Buck发现了嗅觉受体分子家族[1],并因此获得了2004年的诺贝尔生理学或医学奖。
今天,嗅觉又摊上大事了。
浙江大学医学院刘冲团队在《自然》杂志发表重磅研究[2],他们在携带特定基因突变的脑胶质瘤小鼠模型体内发现,嗅觉可以激活相应功能神经环路,通过神经营养因子IGF1信号通路直接调控胶质瘤的发生。
据了解,这也是首次证实嗅觉可以直接调控胶质瘤的发生。另外,这个研究揭示了嗅觉与胶质瘤发生之间存在独特的直接联系,为胶质瘤的临床诊治提供新的思路和靶点。
联想到之前有研究证实视觉刺激可在NF1突变小鼠中促进视神经胶质瘤的发生[3],不禁让人觉得,难道在某些基因突变的情况下,引起神经元活动的刺激可能成为胶质瘤的诱因吗?

研究首页截图
胶质瘤是神经外科最常见的脑肿瘤之一,但又是恶性程度最高、治疗最棘手的病种,胶质母细胞瘤患者经过所有治疗后(手术、放化疗等),其中位生存期也仅为十余个月[4]。因此,亟需开拓新的思路与靶点来打破目前临床诊疗的困境。
刘冲教授团队长期致力于胶质瘤发生与发展的机制研究,他们在前期构建的模拟成人少突胶质前体细胞(OPC)起源的原发胶质瘤小鼠模型(CKO模型,条件性敲除肿瘤抑制基因Trp53和Nf1)中发现,嗅球(嗅觉感受神经元传导的第一站)发生胶质瘤的概率很高,且与嗅觉相关的其他中枢(前嗅核、嗅结节、梨状皮质、杏仁核等)发生胶质瘤的概率也较高,但相比与嗅球,发生的时期较晚。
通过对嗅球亚结构的进一步剖析,他们发现肿瘤几乎都存在并局限于突触小球层。突触小球层是嗅觉环路中第一级神经元(嗅觉感受神经元, ORN)和第二级神经元(僧帽/簇状细胞, M/T cells)的信息交流区域。
这一发现提示嗅觉引起的神经元活动,可能对胶质瘤的发生发展起到重要作用。
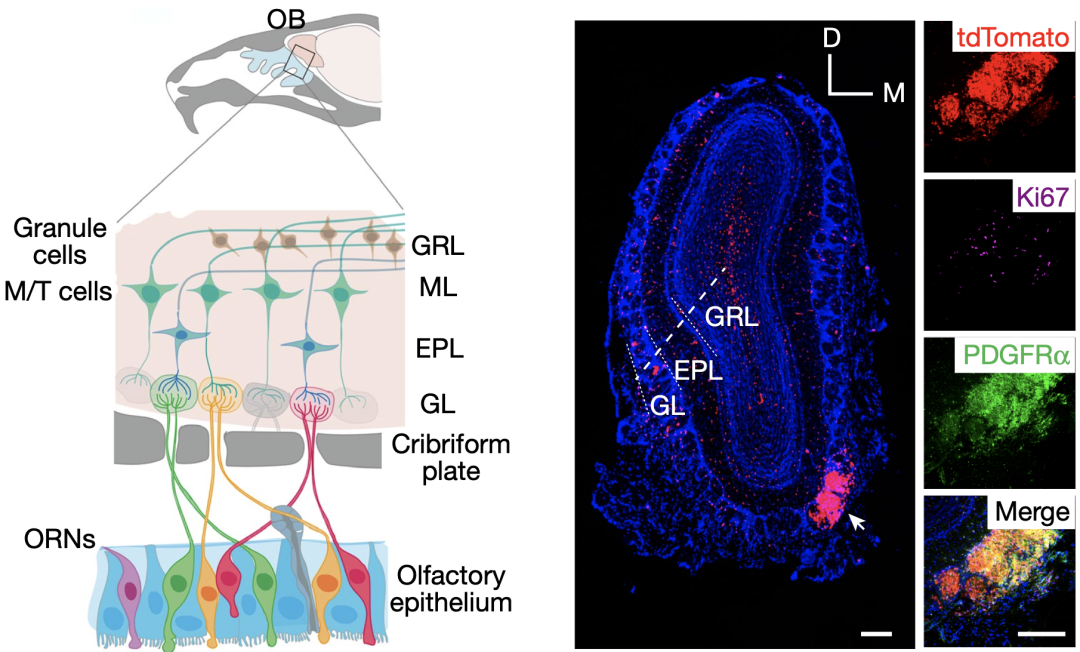
在CKO模型中,肿瘤几乎都存在并局限于嗅球的突触小球层
为了进一步研究嗅觉和胶质瘤发生之间的因果关系,刘冲团队利用化学遗传学技术构建了可以特异性操控嗅觉感受神经元活动的Omp-hM4Di和Omp-hM3Dq转基因小鼠,并将其整合到CKO模型中。
通过在给小鼠使用转基因受体激动剂氯氮平,可在Omp-hM4Di小鼠中导致嗅觉感受神经元细胞膜超极化,抑制嗅觉感受神经元活性,从而减弱外界嗅觉刺激引起的神经元激活;在Omp-hM3Dq小鼠中则可以使嗅觉感受神经元细胞膜去极化,从而导致嗅觉感受神经元在无外界嗅觉刺激下过度激活。
这一技术使得研究人员可以对小鼠的嗅觉输入进行干预,从而探究嗅觉活动对胶质瘤的发生发展是否有直接的促进作用。
结果不出所料,长期服用氯氮平显著减少了CKO_OMP-hM4Di小鼠的嗅球肿瘤体积,即嗅觉感受神经元活动受到抑制后,肿瘤生长也相应被抑制;而在CKO_OMP-hM3Dq小鼠中,长期服用氯氮平则使得肿瘤体积显著增大,即嗅觉感受神经元活动被持续性激活时,肿瘤生长则被促进。
为了更接近生理地对小鼠的嗅觉感受神经元活动进行干预,研究人员通过堵住CKO小鼠的一侧鼻孔(单侧嗅觉剥夺)来减少该侧鼻孔受到的嗅觉刺激。
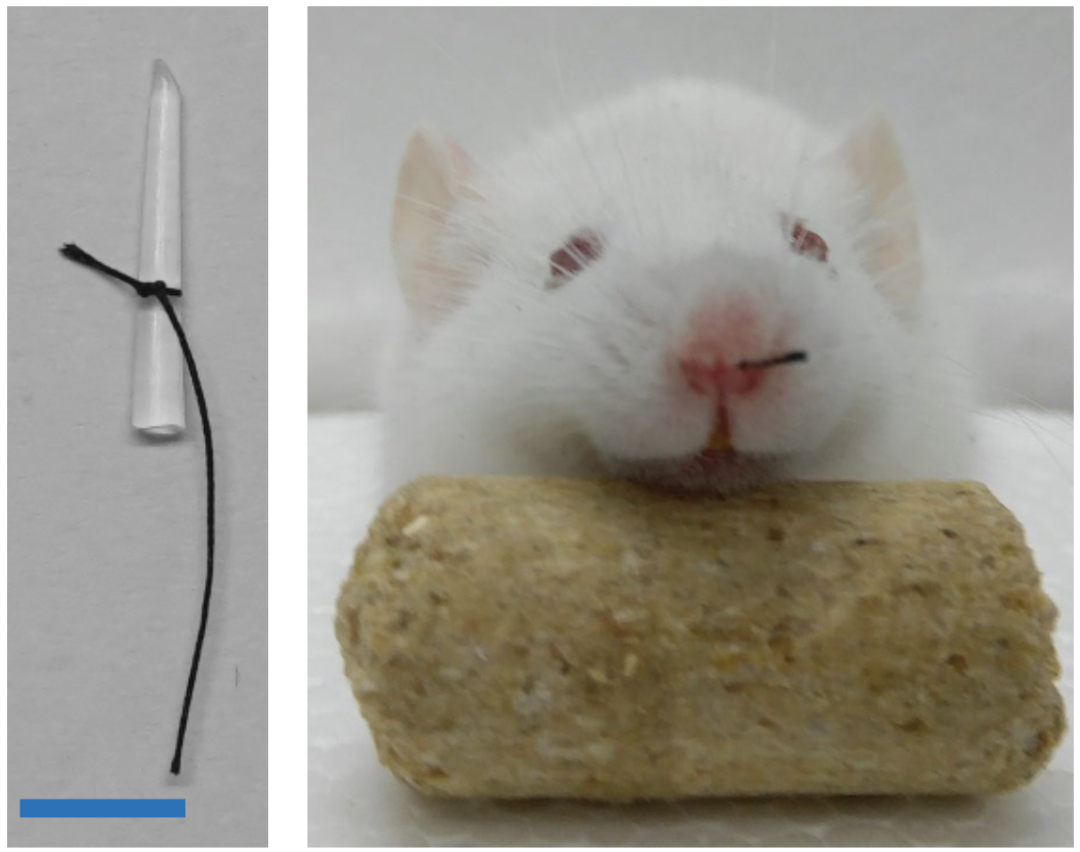
通过堵住CKO小鼠的一侧鼻孔(单侧嗅觉剥夺) ,来减少该侧鼻孔受到的嗅觉刺激
,来减少该侧鼻孔受到的嗅觉刺激
通过这种简单的物理性嗅觉干预,竟也能显著减小嗅觉剥夺侧嗅球肿瘤的体积,并使得突触小球层中突变的OPC细胞增殖显著减少。
以上研究证实了嗅觉刺激所致的嗅觉感受神经元活动可以调控胶质瘤的生长,那其内在的机制是怎样的呢?
通过对单侧嗅觉剥夺小鼠的两侧嗅球组织进行RNA-seq,研究人员筛选出了嗅觉剥夺侧嗅球中有17个基因表达显著下调,并使用RT–qPCR进行验证。进一步对多个基因进行筛选后,发现仅有IGF1可在体外显著刺激OPC的增殖。实际上,刘冲团队在前期研究中就发现过IGF1R(IGF1的受体),在OPC起源的胶质瘤形成中发挥重要作用[5]。
研究人员进一步发现小鼠大脑中IGF1主要在嗅球表达,且嗅觉剥夺侧嗅球中IGF1的表达较对侧显著减少,提示IGF1可能就是嗅觉刺激导致肿瘤发生发展的关键一环。
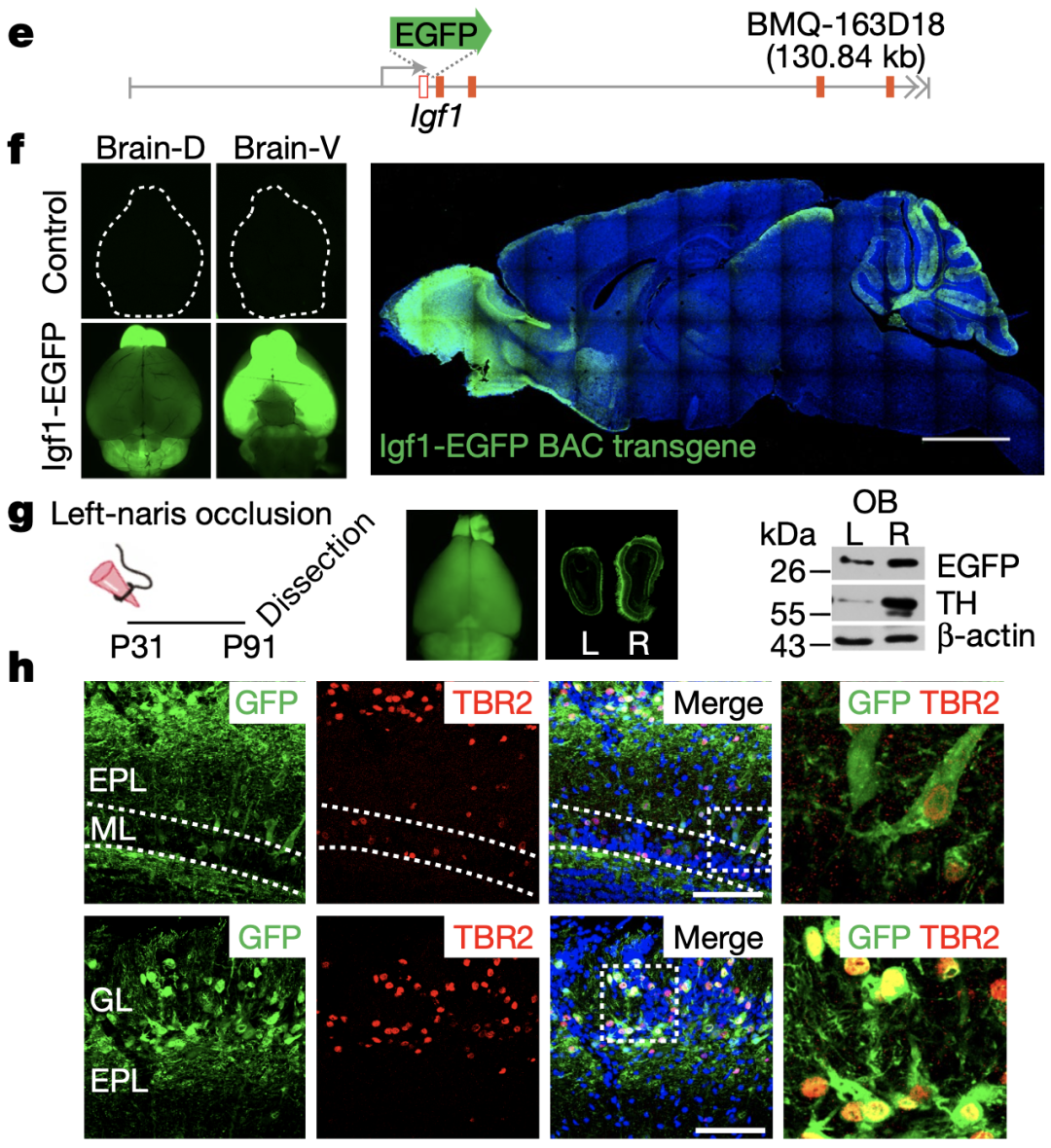
小鼠大脑中IGF1主要在嗅球表达,且嗅觉剥夺侧嗅球中IGF1的表达较对侧显著减少
通过多个细胞标志物的染色,研究人员进一步明确了IGF1由突触小球中的第二级神经元僧帽/簇状细胞表达。
为了明确第二级神经元僧帽/簇状细胞是否通过IGF1在胶质瘤形成中起关键作用,研究人员通过双标记嵌合体分析技术与双重组酶系统,对肿瘤起源与演化实现高分辨率的谱系示踪,同时对肿瘤微环境进行精准的遗传学操控。
利用这一模型,研究人员证明了在第二级神经元僧帽/簇状细胞中特异性地敲除IGF1,可显著抑制嗅球中OPC转化为肿瘤细胞。
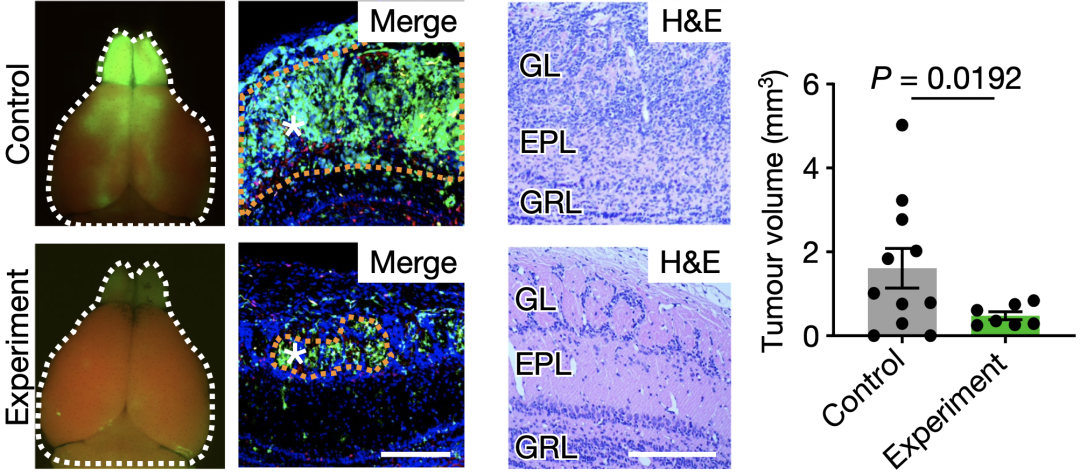
在M/T细胞中特异性地敲除IGF1可显著抑制嗅球中OPC转化为肿瘤细胞
最后,研究人员在CKO_OMP-hM3Dq小鼠中,敲除了IGF1R基因,即在激活嗅觉感受神经元的同时并阻断IGF1-IGF1R信号通路,结果发现之前观察到的由嗅觉感受神经元激活导致的促瘤作用被完全抵消。
这些结果证明,嗅觉刺激主要通过第二级神经元僧帽/簇状细胞来源的IGF1信号通路调控胶质瘤发生。
总的来说,该研究证明了嗅觉刺激可以通过嗅觉感受神经元神经活动刺激第二级神经元僧帽/簇状细胞分泌IGF1,促进胶质瘤的发生发展,再一次揭示了外部环境刺激可能是一种新的胶质瘤诱发因素。同时,该研究提示IGF1可作为胶质瘤治疗的潜在新靶点。
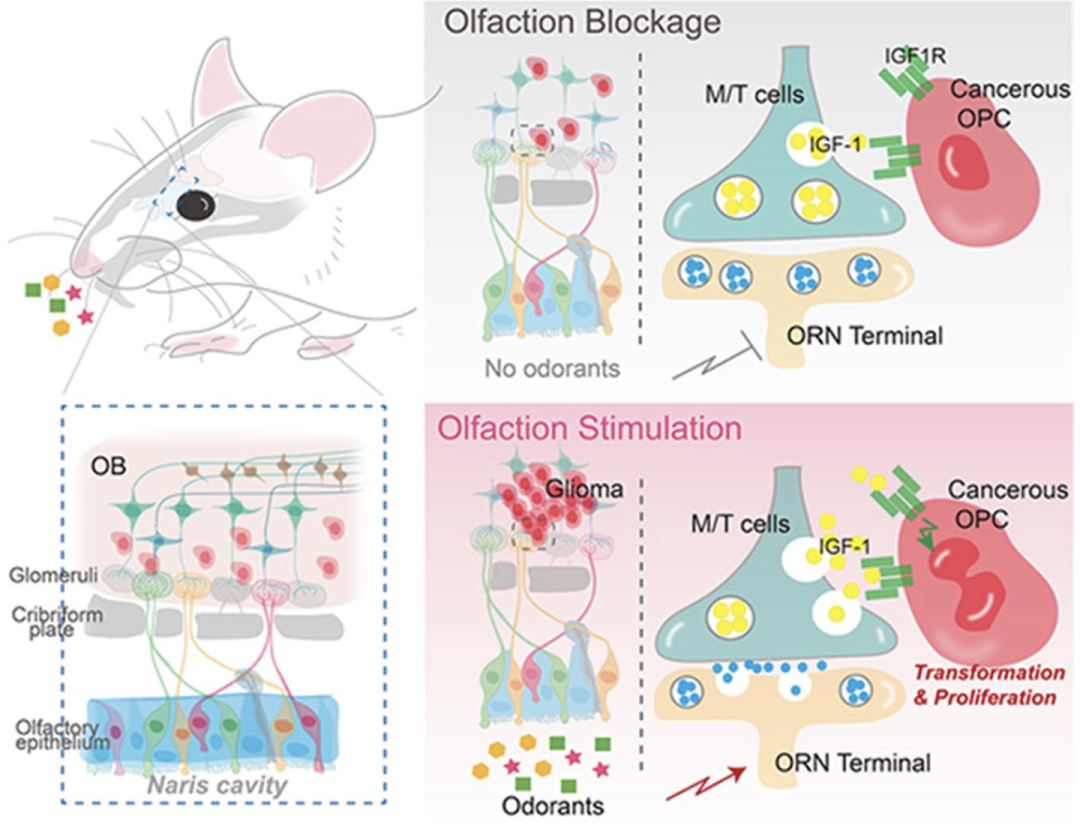
研究机制示意图
既然视觉、嗅觉相继被发现与胶质瘤的发生存在相关性,那么听觉、触觉,甚至思考等精神活动是否会与胶质瘤发生存在联系呢?
不过大家不用担心,目前发现的视觉、嗅觉刺激与胶质瘤的相关性,都是在基因突变的小鼠中发现的(Trp53,NF1),对于正常人群来说,目前还没有证据表明正常的感觉刺激与胶质瘤的发生有关。
希望能有更多的相关研究,为胶质瘤的诊疗提供新思路、新策略。
参考文献
1.Buck L, Axel R: A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell 1991, 65(1):175-187.
2.Chen P, Wang W, Liu R, Lyu J, Zhang L, Li B, Qiu B, Tian A, Jiang W, Ying H et al: Olfactory sensory experience regulates gliomagenesis via neuronal IGF1. Nature 2022.
3.Pan Y, Hysinger JD, Barron T, Schindler NF, Cobb O, Guo X, Yalcin B, Anastasaki C, Mulinyawe SB, Ponnuswami A et al: NF1 mutation drives neuronal activity-dependent initiation of optic glioma. Nature 2021, 594(7862):277-282.
4.Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, Hawkins C, Ng HK, Pfister SM, Reifenberger G et al: The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 2021, 23(8):1231-1251.
5.Tian A, Kang B, Li B, Qiu B, Jiang W, Shao F, Gao Q, Liu R, Cai C, Jing R et al: Oncogenic State and Cell Identity Combinatorially Dictate the Susceptibility of Cells within Glioma Development Hierarchy to IGF1R Targeting. Adv Sci (Weinh) 2020, 7(21):2001724.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


